
题目列表(包括答案和解析)
1.(2006广东,2)同主族两种元素原子核外电子数差值可能为
A. 6 B. 12 C. 26 D. 30
9、电子层与电子数的倍比关系(短周期元素)
(1) 若原子的最外层电子数与最内层电子数的比值为a,则有:(1)a=1/2为第IA族元素;(2)a=1为第IIA族元素或H、He;(3)a=2为第IVA族元素;(4)a=3为第VIA族元素;(5)a=4为0族元素。
(2) 若原子的最外层电子数与次外层电子数的比值为b,则有:(1)b=1/8为Na;(2)b=1/4 为Mg;(3)b=1/2为Li、Si;(4)b=1为Be、Ar;(5)b=2为C;(6)b=3为O;(7)b=4为Ne。
(3) 若原子的最外层电子数与电子总数的比值为c,则有:(1)c=1/6为Mg;(2)c=1/3为Li、P;(3)c=1/2为Be;(4)c=1为H、He。
(4) 原子的最外层电子数与核外电子层数相等为H、Be、Al。
典例剖析
[例1]A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:A__________、B__________、C________。A的原子结构示意图为___________,B在周期表中的位置___________,C的离子结构示意图为__________,A的氢化物分子式为_________;B、C的最高价氧化物水化物的分子式分别为_______、_________,它们的酸性_______比________强。
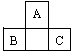
解析:由于A、B、C均为短周期元素,且根据其位置可判断A不可能是第一周期的氢或氦元素,A应为第二周期元素、B、C为第三周期元素。设A的原子序数为x,B位于A下一周期A的前一个主族,C位于A下一周期A的后一个主族。由于第二、第三周期同主族元素原子序数相差8,因此B的原子序数为x+8-1=x+7,C的原子序数为x+8+1=x+9。根据B、C两元素原子序数之和是A原子序数的4倍,可得下式:4x=x+7+x+9 x=8。
答案:A原子序数为8,B原子序数为15,C原子序数为17。元素符号A为O,B为P,C为Cl;A的原子结构示意图: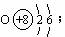 ;A的氢化物分子式为H2O;B、C最高价氧化物对应水化物分子式为:H3PO4、HClO4;酸性HClO4比H3PO4强。
;A的氢化物分子式为H2O;B、C最高价氧化物对应水化物分子式为:H3PO4、HClO4;酸性HClO4比H3PO4强。
[例2]X和Y的原子序数都小于18,两者都能组合化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是
A、n+11 B、n-5 C、n+3 D、n-6
解析: 根据化学式X2Y3,可知X显正三价,Y显负二价。在原子序数1-18号的元素中,能组成X2Y3型化合物的X元素是5B、13Al、8O、Y元素可能是8O和16S。
(1)当X是5B,Y是16S时,原子序数符合n和n+11
(2)当X是13Al,Y是8O时,原子序数符合n和n-5
(3)当X2Y3是B2O3和Al2S3时,原子序数符合n和n+3
(4)当X是7N,Y是8O时,原子序数符合n和n+1
答案:D
[例3]下表是元素周期表的一部分,回答下列有关问题:

(1)写出下列元素符号:① ,⑥ ,⑦ , 11 。
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ,写出三者之间相互反应的化学方程式。
(4)在这些元素中,原子半径最小的是 ,原子半径最大的是 。
(5)在③与④中,化学性质较活泼的是 ,怎样用化学实验证明?答: 。在⑧与 12 中,化学性质较活泼的是 ,怎样用化学实验证明?答: 。
解析:解答本题关键要掌握:①1-20号元素的名称及符号;②元素周期表的结构;③能根据元素周期表中元素性质递变规律进行分析、判断。
答案:(1)N;Si;S;Ca (2)K;F;Ar(3); HClO4;KOH;Al(OH)3,3 HClO4+ Al(OH)3= Al( ClO4)3+3H2O HClO4+KOH=K ClO4+ H2O KOH+ Al(OH)3=KAlO2+2 H2O。
(4)K;F(5)Na;可以用它们跟水反应的实验证明:钠跟水剧烈反应,放出氢气,并生成强碱;Mg跟沸水才反应,放出氢气,并生成中强碱 Mg(OH)2; Cl;可用氯气通入溴化钠溶液的实验证明:溶液呈棕红色,发生的反应为Cl2+2NaBr=2NaCl+Br2。
[例4]在下列各元素组中,除一种元素外,其余都可以按照某种共性归属一类,请选出各组的例外元素,并将该组其他元素的可能归属按所给六种类型的编号填入表内。
|
元素组 |
例外元素 |
其他元素所属编号 |
|
(1)S、Na、Mg |
|
|
|
(2)N、P、Sn、As |
|
|
|
(3)K、Ca、Al、Zn |
|
|
|
(4)Cu、Fe、Ag、Ca |
|
|
其他元素所属类型编号:①主族元素,②过渡元素,③同周期元素,④同主族元素,⑤金属元素,⑥非金属元素。
解析:(1)中Na、Mg、S为同周期元素,(2)中N、P、As为ⅤA族元素,(3)中K、Ca、Al是主族元素,(4)中Cu、Fe、Ag是过渡元素
答案:(1)N,③(2)Sn,④(3) Zn,①(4) Ca,②。
[例5]9.6g元素A与4.2g元素B含有相同的原子数,A和B原子核中质子数与中子数相等,已知A元素在其最高价氧化物中的含量是40%,在其氢化物中含量为94.1%。试计算A、B两元素的原子量,并推算出它们在周期表中的位置。
解析:设该氢化物为:HxA,该最高价氧化物分子式应该为:A2O8-x

由于9.6g元素A与4.2g元素B含有相同的原子数,设B的原子量为y
由 
A的相对原子质量是32,其中子数与质子数相等,因此质子数为16的是硫元素,在第三周期ⅥA族。
B的相对原子质量是14,其中子数与质子数相等,因此质子数为7的是氮元素,在第二周期ⅤA族。
知能练习
8、主族族序数与周期序数的规律
(1) 关系式:主族族序数=最外层电子数;周期序数=电子层数。
(2)设主族族序数为a,周期数为b,则:当a:b<1 时,为金属元素,且比值越小,元素的金属性越强;当a:b=1时,为两性元素(H除外),其最高价氧化物为两性氧化物,最高价氧化物的水化物为两性氢氧化物。 当a:b>1时,为非金属元素,且比值越大,元素的非金属性越强。
7、半径大小规律
(1) 原子半径:同主族--从上到下逐渐增大;同周期--从左到右逐渐减小(0族除外)。
(2) 离子半径:同主族--同价离子从上到下逐渐增大;同周期--阴离子半径大于阳离子半径;具有相同的电子层结构的离子--核电荷数越大,离子半径越小。
(3) 同种元素的各种微粒,核外电子数越多,半径越大;反之,核外电子数越少,半径越小(如 )。
6、金属性、非金属性变化规律
(1) 同一周期,从左到右(0族除外)金属性减弱,非金属性增强;同一主族,从上到下金属性增强,非金属性减弱。金属性最强的位于左下角的铯,非金属性最强的是位于右上角的氟。
(2)金属性越强,单质越容易跟水或酸反应置换出氢,对应的最高价氧化物水化物碱性越强;非金属性越强,跟氢气反应越容易,生成的气态氢化物越稳定,对应的最高价氧化物水化物酸性越强。
5、分界线规律
位于金属与非金属之间的分界线,右上方的元素为非金属(周期表中的颜色为深绿色),在此可以找到制造农药的元素(如Cl、P等),左下角为金属元素(H除外),分界线两边的元素一般既有金属性,又有非金属性;能与酸和碱反应(如Be、Al等),还可找到制造半导体材料的元素(如Si、Ge等)。
4、对角线规律
金属与非金属分界线对角(左上角与右下角)的两主族元素性质相似,主要表现在第2、3周期(如Li和Mg、Be和Al、B和Si)。
3、化合价规律
(1) 同周期元素主要化合价:最高正价由+1→+7(稀有气体为0价)递变、最低负价由-4→-1递变。(2) 关系式:最高正化合价+|最低负化合价|=8; 最高正化合价=主族族序数=最外层电子数=主族价电子数。(3) 除第VIII族元素外,原子序数为奇(偶)数的元素,元素所在族的序数及主要化合价也为奇(偶)数。
2、数目规律
(1) 元素种类最多的是第IIIB族(32种)。 (2) 同周期第IIA族与第IIIA族元素的原子序数之差有以下三种情况:第2、3周期(短周期)相差1;第4、5周期相差11;第6、7周期相差25。 (3)设n为周期序数,每一周期排布元素的数目为:奇数周期为 (n+1)2/2;偶数周期为(n+2)2/2。如第3周期为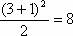 种,第4周期为
种,第4周期为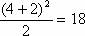 种。 (4) 同主族相邻元素的原子序数:第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA-VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。
种。 (4) 同主族相邻元素的原子序数:第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA-VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。
1、最外层电子数规律
(1)最外层电子数为1的元素:方族(IA族)、副族(IB、VIII族部分等)。(2)最外层电子数为2的元素:主族(IIA族)、副族(IIB、IIIB、IVB、VIIB族)、0族(He)、VIII族(26Fe、27Co等)。 (3)最外层电子数在3~7之间的元素一定是主族元素。 (4)最外层电子数为8的元素:0族(He除外)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com