
题目列表(包括答案和解析)
(二)催化效果比较
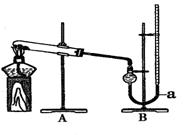 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验 |
KClO3质量 |
其它物质的量 |
待测数据 |
|
实验Ⅰ |
1.2g |
无其他物质 |
|
|
实验Ⅱ |
1.2g |
CuO 0.5g |
|
|
实验Ⅲ |
1.2g |
MnO2 0.5g |
|
回答下列问题:
(3)上表所列实验中的“待测数据”指
(4)若要证明实验Ⅱ中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住装置B中的乳胶管a,拔去干燥管上单孔橡皮塞,
(5)为探究CuO在实验Ⅱ中是否为催化剂,需补做如下实验(无需写出具体操作):
a. ,b.检验CuO的化学性质有没有改变。
(一)制取CuO
实验步骤:①称取5 g CuSO4·5H2O,研细后倒入烧杯中,加30 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀为止,然后将所得混合物转移到蒸发皿中,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题: (1)上述实验步骤中需要使用玻璃棒的是 (填实验步骤序号),
(2)步骤③中洗涤沉淀的操作方法是
17. (6分)下列有关实验的叙述,正确的是 (选填字母序号)。
A.制备乙酸乙酯时,将乙醇和乙酸依次倒入到浓硫酸中
B.用干燥且洁净的玻璃棒蘸取待测液滴到放在表面皿上的pH试纸上
C.滴定管洗净后,经蒸馏水润洗即可注入标准液进行滴定
D.铜片跟稀硝酸反应产生的气体可用排水法收集
E.用浓氨水洗涤做过银镜反应的试管
F.在溴水中滴入少量苯酚溶液有白色沉淀生成
18. (10分)某实验小组欲比较CuO和MnO2对KClO3分解速率的影响,进行了如下实验:
16.左多巴是一种著名的药物,2000年Nobel医学奖和2001年Nobel化学奖都跟它有关。
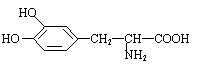
它的结构简式和学名为:
3-(3,4-二羟基苯基)-2-氨基丙酸 。 该名称中,“复杂基团”作为一个整体,用一个括号括起。括号内的3,4表示羟基在苯环的位置,括号前和氨基前的3,2分别表示这两个基团在丙酸分子中碳链的位置。如果保持名称中的括号、汉字不变,仅仅改变表示位置的4个阿拉伯数字,可以写出多少种同分异构体
A、20种 B、23种 C、24种 D、11种
第Ⅱ卷(非选择题,共86分)
15. 某结晶水合物的化学式为A·H2O,其相对分子质量为B,在60℃时m g 该晶体溶于ng
水中,得到v mL 密度为d g· mL-1 的饱和溶液,下述表达式或判断正确的是
A.该溶液物质的量浓度为(1000m/BV)mol·L-1
B.60℃时A 的溶解度为(100m(B-18)/nB)g
C. 该溶液溶质的质量分数为(m/(m+n))×100%
D.60℃时,将10g A 投入到该饱和溶液中,析出晶体大于l0g
14. 时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。主要步骤如下:
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去。
②再加入过量的KI,在酸性条件下,使IO3-完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为:N2H4+2I2==4I-+N2+4H+
④将生成的I-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化。
⑥ 将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准液滴定,方程式为:2Na2S2O3+I2==Na2S4O6+2NaI
经过上述放大后,溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积相等):
A.2倍 B.4倍 C.6倍 D.36倍
13.已知甲为恒温恒压容器,乙为恒温恒容容器。初始时,两容器的温度、体积相同,两容器中均充入2molSO2和lmolO2,且发生反应为2SO2(g)+O2(g) 2SO3(g);△H<0;当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
2SO3(g);△H<0;当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
A.向甲容器中再充人一定量的氦气 B.向乙容器中再充人2mol的SO3气体
C.适当降低乙容器的温度 D.缩小甲容器的体积
12.下列离子方程式书写正确的是
A.向CaCl2溶液中通入少量CO2气体: Ca2++CO2+H2O===CaCO3↓+2H+
B.碳酸氢钠溶液与硫酸氢钠溶液反应: HCO3-+H+=CO2↑+H2O
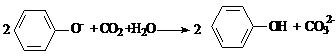
C.向苯酚钠溶液中通入少量CO2:
D.含有FeBr2溶液中通入足量的Cl2: 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
11.镍氢电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。镍氢电

池的总反应式是:H2+2NiO(OH) 2Ni(OH)2,据此反应判断,下列叙述中正确的是
A.电池放电时,电池负极周围溶液的pH 不断增大
B.电池充电时,阳极反应为:Ni(OH)2 + OH- - e-= NiO(OH) +H2O
C.电池充电时,氢元素被还原
D.电池放电时,负极反应为:H2-2e-=2H+
10.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备--2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备--2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生还原反应
B.湿法中每生成1mol Na2FeO4共转移3mol电子
C.干法中每生成1mol Na2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com