
题目列表(包括答案和解析)
3.在实验室,需储存在棕色试剂瓶中的药品是
A.浓盐酸 B.浓硫酸
C.浓硝酸 D.硅酸钠溶液
2.下列物质均有漂白作用,但其中一种与其它三种的漂白原理不同的是
A. Na2O2 B. HClO
C. O3 D. SO2
1.据日本气象报道,2004年的臭氧空洞比往年小,即使在应该最大的9月份,臭氧空洞面 积也仅相当于南极大陆的1.5倍,2004年臭氧空洞的减小是自上个世纪90年代以来首次出现的现象。下列有关臭氧的说法中正确的是
A.弥补臭氧空洞的最好方法是工业化制取臭氧,再释放到太空中
B.臭氧空洞的逐渐减小,与目前人们减少或不再使用氟氯代烃有关
C.臭氧和氧气互为同分异构体
D.臭氧空洞的减小主要是因为部分臭氧转化成氧气
25、(10分)甲、乙两个研究小组,用以下两种方法由Cu粉制Cu(NO3)2溶液。
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗的O2的物质的量是 ,
消耗的HNO3的物质的量是
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L (不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是 mol。为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,则消耗O2的物质的量是 mol;若将生成的气体通入NaOH溶液中,气体被完全吸收,产
物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是 mol。
 |
|||
|
24、(8分)2006年是中国环保事业取得长足进步的一年。江南某厂平均每天产生约600 m3含氨废水(NH3 的浓度为153 mg·L-1,密度为1 g·cm-3)。该厂采用下列方法对废水进行联合处理和利用。
方法1:对废水进行加热蒸发得到NH3,使废水中的NH3 的浓度降为17
mg·L-1。对加热蒸发得到的NH3进行合理利用:用一定量空气氧化(设空气中氧气的体积分数为20%),发生的主要反应有: 4NH3 + 5O2  4NO + 6H2O,
4NO + 6H2O,
4NO + 3O2 + 2H2O === 4HNO3, 副反应有:4NH3 + 3O2 === 2N2 + 6H2O
方法2:向方法1处理过的废水中,加入甲醇,在微生物作用下发生如下反应:
2O2 + NH3 = == NO3- + H+ + H2O
6NO3- + 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若废水加热前后的体积和密度近似认为不变,试进行下列计算:
(1)方法1中,若90% NH3转化为硝酸,10% NH3发生了副反应,则消耗标准状况下的空气多少立方米?
(2)方法2中,若NH3 的 转化率为95%,则消耗甲醇多少千克?
23.(14分)已知:
|


|




 R-CH2-C-CH2-R’
R-CH2-C-CH2-R’
|
|
|
|
 O
O
 现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
试回答下列问题:
(1)写出下列物质的结构简式:A____________C____________D____________。
(2)反应①和②的反应类型:反应①____________ 反应②____________
(3)写出下列变化的化学方程式:
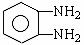 ①E与邻苯二胺(
)缩聚生成一种合成纤维:
①E与邻苯二胺(
)缩聚生成一种合成纤维:
②F→G_________________________________________________
③A→H_________________________________________________
22、 (8分) 据某国时尚杂志报道,一种名为苹果醋(ACV)的浓缩饮料多年来风靡当地。,苹果酸是这种饮料的主要酸性物质,对此酸的化学分析如下:
a.燃烧的产物是CO2和H2O,碳、氢质量分数分别为:C:35.82%,H:4.48%;
b.0.001mol该酸与足量的NaHCO3反应,放出44.8mLCO2;或与足量的Na反应放出33.6mLH2(气体体积均已折算为标准状况);
c.结构分析表明,该分子中存在四种化学环境不同的碳原子
试回答下列问题:
(1)苹果酸的化学式为 ,结构简式为
(2)写出该酸在一定条件下分子内脱去一分子水的产物的可能结构简式
、 (写出两种即可)
21.(14分)化学科研小组的同学在精确测试Na2SO3溶液的pH时,遇到了困惑。为此,他们进行了冷静的思考和准备,决心重新实验,揭开奥秘。请你了解情况,参与交流讨论。
[查阅资料]①常温下0.1mol·L-1的H2SO3溶液的pH约为2.1。
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol·L-1的H2S溶液的pH约为4.5。
[实验操作]①准确称取纯净的Na2SO3·7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8。
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重,质量为12.60g。
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250mL溶液,测得pH=10.3。
[分析猜想] Na2SO3·7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中称量操作至少进行 次。
(2)给Na2SO3·7H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明。
。
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是 。
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是
。实验③中溶液的pH=10.3的原理是(以相关的离子方程式表示) 。
(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证。请简单叙述实验步骤、现象和结论。
20.(10分)2004年美国火星探测车在火星大气层中检测到了A气体。资料显示,A气体分子是一种三原子分子,其相对分子质量为60.0,在地球环境下A不太稳定,易分解得到一种单质和一种化合物。粉末状的KSCN与浓硫酸在一定条件下可得到气体A和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1
(1)试推测火星大气层的温度比地球环境高还是低,简述你的理由。
(2)试确定A的化学式 。
(3)写出KSCN与浓硫酸反应的化学反应方程式 。
(4)A分解得到一种单质和一种氧化物,写出A分解的化学反应方程式 。
(5)B与SO3反应得到A与一种淡黄色的固体单质。已知B由两种元素组成,A和B分子中原子的最外层电子总数相等,B中两元素的质量比为3∶16。试写出B与SO3反应制备A的化学反应方程式: 。
19.(6分)化学键的键能是原子间形成1mol化学键(或其逆过程)时释放(或吸收)
的能量。以下是部分共价键键能数据:H-S 364kJ·mol-1,S-S 266kJ·mol-1,
O=O ,496kJ·mol-1, H-O 464kJ·mol-1。
 已知:
已知:
2H2S(g)+O2(g)=2S(g)+2H2O(g);△H1
2H2S(g)+3O2(g)=2SO2+2H2O(g); △H2=-1000kJ·mol-1
反应产物中的S实为S8分子,是一个八元环状分子(如图)
(1)试根据上述数据计算可得△H1= kJ·mol-1
(2)将a mol H2S与b mol O2混合进行上述反应,当a>2b时,反应放热 kJ,
将a mol H2S与b mol O2混合进行反应,当3a<2b时,反应放热 kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com