
题目列表(包括答案和解析)
29.(12分)一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
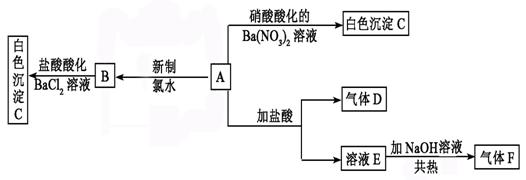
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。
试回答下列问题:
(1)写出下列物质化学式:
A:________________ _ C:____ _ ____________
(2)写出气体F的电子式 ,其分子空间构型为
(3)写出下列反应的离子方程式:
①E→F: 。
②A→B: 。
(4)在检验SO42-时,当确定溶液中不含 等干扰离子存在时可选用盐酸酸化的BaCl2溶液作试剂检验SO42-;在确定溶液中不含 等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂检验SO42-。
28.(12分)A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子核外最外层电子数是次外层电子数的2倍。C元素是地壳里含量最多的元素。D是短周期元素中金属性最强的元素。E与F的位置相邻,F的最高价氧化物的水化物为最强酸。
(1)推断B在元素周期表中的位置:第 周期, 族。
(2)画出F的原子结构示意图: 。
(3)C、D可形成淡黄色的粉末,其电子式为: 。
(4)写出A与C形成的10电子微粒的化学式: 、 、 。
(5)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:
(从大到小排列) 。
(6)常温下,1mol A元素的单质与C元素的单质化合,放出286kJ的热,写出反应的
热化学方程式: 。
27.(13分)某学生利用以下装置探究氯气与氨气之间的反应。其中A,F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
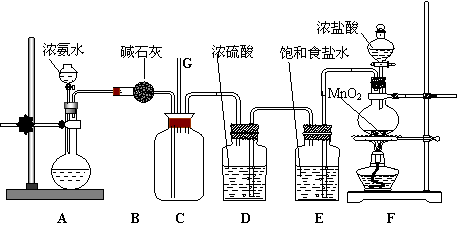
请回答下列问题:
(1)装置F中发生反应的离子方程式为
(2)装置A中的烧瓶内固体可以选用 (选填以下选项的代号)。
A.生石灰 B.二氧化硅 C.五氧化二磷 D.烧碱
(3)B装置的作用 ;E装置的作用 ;
(4)通入C装置的两根导管左边更长、右边更短,原因是
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?

26.(3分)判断下列实验操作或对实验事实的叙述中正确的是
A.用托盘天平称取10.50 g干燥的NaCl固体。
B.中和热的测定所需的玻璃仪器只有烧杯、量筒。
C.采取降温结晶可以提纯混有少量氯化钾的硝酸钾。
D.测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液。
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌。
F.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
G.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
25.(9分)向现有下列电解质溶液:① Na2CO3 ② NaHCO3 ③ CH3COONa
④  -ONa ⑤NaOH (用每种物质相应的序号填空)
(1)在五种电解质溶液中,加入AlCl3溶液有气体产生的是
-ONa ⑤NaOH (用每种物质相应的序号填空)
(1)在五种电解质溶液中,加入AlCl3溶液有气体产生的是
写出②与AlCl3反应的离子方程式 。
(2)若上述五种溶液的物质的量浓度均为0.2mol·L-1,将它们稀释相同倍数时,其pH变化最大的是 。
(3)当五种溶液的物质的量浓度相同时,其pH值由大到小的顺序是(填序号):
。

24.(6分)在一容积为2.0L且容积不变的密闭容器中加入适量碳粉和0.20 mol H2O。
 在800℃条件下,经20s后达到如下化学平衡(第一平衡):
在800℃条件下,经20s后达到如下化学平衡(第一平衡):
C(s) + H2O(g) 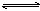 CO(g) + H2(g);ΔH >0。已知平衡时,CO为0.12mol。试填空:
CO(g) + H2(g);ΔH >0。已知平衡时,CO为0.12mol。试填空:
(1)若用v(H2O)表示反应前20s内平均速率,则v(H2O)= 。
(2)若在上述平衡混合物中加入少量Na2O固体,并在此温度下再次达到新平衡(第二平
衡),则平衡时H2的物质的量 (填“增大”“减小”或“不变”)。
理由是 。
(3)若向上述第一平衡的混合物中,再充入a mol H2(a < 0.12),在相同条件下达到新的
平衡(第三平衡),此时,CO的物质的量n的取值范围是 。
23.(7分)某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
①该反应的氧化剂是 ;氧化产物是 。
②如果该反应方程式中I2和KIO3的系数都是5,KMnO4的系数是 ,
若有I2和KIO3各5mol生成,则反应中转移的电子数为 mol。
③该方程式中I2和KIO3的系数若未作限定,可能的配平系数有许多组。
原因是: 。
22.将一定量的锌与l00 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L测得溶液中pH=1, 则下列叙述中错误的是
A.气体 A 为 SO2 和 H2的混合物
B.气体 A 中 SO2 和 H2的体积比为 4∶l
C.反应中共消耗锌 97.5 g
D.反应中共转移电子3 mol
高三化学上学期质量检测试卷
化 学 试 题
第Ⅱ卷 (非选择题 共84分)

21.下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是 A.CH2=CH2、C2H5OH、HOCH2CH2COOH B.CH2O、C2H4O2、C6H12O6 C.C6H6、C5H12、C7H6O2 D.H2、CO、CH3OH
20.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g )+3H2(g) 2NH3(g),△H<0.673K、30Mpa下n(NH3)和n(H2)随时间变化的
2NH3(g),△H<0.673K、30Mpa下n(NH3)和n(H2)随时间变化的
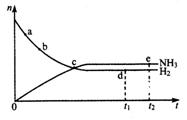 关系如图所示。下列叙述正确的是
关系如图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d (t1时刻)和点e (t2时刻)处n (N2)不一样
D.其他条件不变,773K下反应至t1时刻,
n(H2)比图中d点的值小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com