
题目列表(包括答案和解析)
28.A(10分)研究表明,火灾中绝大多数人的第一死因并非高温烘烤或火烧,而是慌乱奔跑时吸入烟雾中毒。且起火的建筑装修越豪华,这一点越明显。聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:
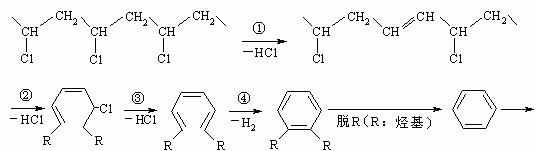
请回答下列问题:
(1) 火灾中由聚氯乙烯产生的有害气体,其化学成分主要是 ,你认为其中含量最大的为 ,在火灾现场,为防止气体中毒的防护措施是 ;
(2)工业上用乙烯和氯气为原料经下列各步合成PVC:


 乙烯
甲
乙
PVC
乙烯
甲
乙
PVC
乙是PVC的单体,其结构简式为 ,反应①、③的化学方程式分别为
、 。
(3)聚氯乙烯可以制成保鲜膜,化学工作者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。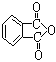 邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲
邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲
酸酐( ) 是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式
为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式: 。
27、(10分)煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:C+H2O(g) CO+H2,CO和H2的混合气体是合成多种有机物的原料气。下图是合成某些物质的路线。其中,D易溶于水,且与CH3COOH互为同分异构体,既能与新制的Cu(OH)2反应,又能发生酯化反应;F分子中的碳原子数是D的3倍;H经催化氧化可得到G。请回答下列问题:
CO+H2,CO和H2的混合气体是合成多种有机物的原料气。下图是合成某些物质的路线。其中,D易溶于水,且与CH3COOH互为同分异构体,既能与新制的Cu(OH)2反应,又能发生酯化反应;F分子中的碳原子数是D的3倍;H经催化氧化可得到G。请回答下列问题:
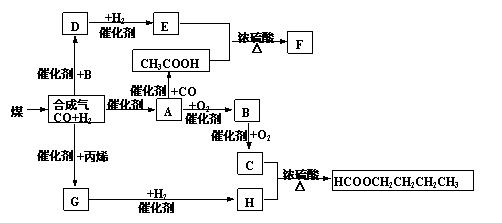
⑴写出下列物质的结构简式:A H ;指出A和H的关系: 。
⑵写出下列反应的化学方程式:
CH3COOH+E→F ;
D与新制的Cu(OH)2共热 。
26、(7分)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)== 1.8×10-10,Ksp(AgY)== 1.0×10-12,Ksp(AgZ)== 8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液 表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为
(4)由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:
0.1mol·L-1NaHA溶液中各种离子浓度由大到小的顺序是:
25、(11分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
 H2A
H2A H++HA-
HA- H++A2-
回答下列问题:
(1)Na2A溶液是 (填“酸性”,“中性”,或“碱性”)。
理由是 (用离子方程式表示)
(2)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1 B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) D.c(Na+)=2c(A2-)+2c(HA-)
(3)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是 0.1mol·L-1(填“<”,“>”,“=”),理由是:
24、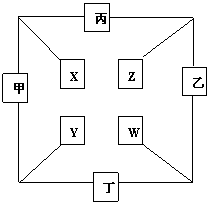 (12分)甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如下图所示。又知:
(12分)甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如下图所示。又知:
①甲、乙、丙均为前三周期元素的单质,
常温下为气态,丁是日常生活中的一种常见金属。
②常温下X为无色液体,Y是黑色固体。
③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成
棕黄色的烟,W的水溶液呈黄色。请回答:
(1)根据图示关系写出下列物质相应的化学式及电子式:
①写化学式: 甲: ;乙: ;丙: ;丁: 。
②写电子式:X: ; Z: 。
这两种物质均属于 化合物。
(2)丁在甲和X同时存在的条件下,可以被腐蚀,写出电极反应式:
负极: ;正极: 。
(3)将少量W的溶液滴入沸水中,反应的化学方程式为 。
(4)写出由Y制取丁的化学方程式: 。
(5)若在一定条件下丁分别与X、Z发生反应生成等物质的量的气体,则消耗丁的物质的量之比是: 。
23、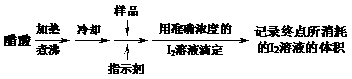 (10分)维生素C又名抗坏血酸,其化学式为:C6H8O6
。它具有较强的还原性,在空气中易被氧化。在酸性溶液中能发生反应:C6H8O6+I2→C6H6O6+2HI。以下是测定某样品中维生素C的含量的操作过程:
(10分)维生素C又名抗坏血酸,其化学式为:C6H8O6
。它具有较强的还原性,在空气中易被氧化。在酸性溶液中能发生反应:C6H8O6+I2→C6H6O6+2HI。以下是测定某样品中维生素C的含量的操作过程:
请回答下列问题:
(1)测定过程煮沸的目的是 。
(2)滴定时应用 作指示剂,滴定至终点的现象是 。
(3)滴定过程所需用到的仪器有(填仪器名称) 。
(4)滴定管用碘溶液润洗后,向滴定管中装入碘溶液的操作过程是 。
22.(10分)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
Ⅰ. 制取氧化铜 ①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解; ②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤①、③中研磨固体所用仪器的名称是___________________;
(2)步骤③中洗涤沉淀的操作是__________________________________
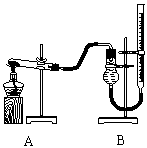 Ⅱ.证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用右图装置进行实验,实验时均以生成25 mL气体为准,
Ⅱ.证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用右图装置进行实验,实验时均以生成25 mL气体为准,
其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2 g |
无其他物质 |
|
|
⑤ |
1.2 g |
CuO 0.5 g |
|
|
⑥ |
1.2 g |
MnO2 0.5 g |
|
回答下列问题:
(3)上述实验中的“待测数据”指_____________;
(4)本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
(5)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,___________________________________;
(6)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,b.CuO的化学性质有没有改变。
21、(10分)某学校设计了一节实验活动课,让学生从废旧电池中回收碳棒、MnO2、、NH4Cl、ZnCl2等物质,整个实验过程如下。试回答有关问题:
(1)干电池的构造和工作原理:
右图为干电池的基本构造图,该电池的工作原理是Zn+2MnO2 +2NH4+==Zn2++ Mn2O3+2NH3↑,则干电池工作时负极上的电极反应为: ,正极反应中前后经历了下列两个反应,即2 NH4++2e-==H2+2NH3↑,MnO2、的作用是了除去正极上的产物氢气,该反应的化学方程式为2MnO2+H2==H2O+Mn2O3,由以上两个反应式可知,正极上发生的电极反应为 。
(2)锌皮和碳棒的回收:
用钳子和剪刀剪开回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入烧杯中。
(3)NH4Cl、ZnCl2的提取、检验和分离:
① 如何从黑色粉末中提取NH4Cl、ZnCl2的等晶体的混合物?写出简要的实验步骤:
。
② 设计简单的实验证明所得晶体中含有NH4+。
实验步骤:
实验现象:
有关的离子方程式:
③ 用什么方法可将NH4Cl、ZnCl2的晶体混合物分离开?
④ 最后剩余的黑色残渣的主要成分是二氧化锰,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的仪器除坩埚、泥三角外,还需要的玻璃仪器有 。
20、有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,下图所示的是某有机物分子的结构简式,其中带“*”碳原子就是手性碳原子。

当此有机物分别发生下列反应后,生成的有机物分子中仍含有手性碳原子的是
A.与乙酸发生酯化反应 B.与NaOH水溶液反应
C.与银氨溶液作用只发生银镜反应 D.催化剂作用下与H2反应
第Ⅱ卷 非选择题(共80分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com