
题目列表(包括答案和解析)
22.(10分)(1)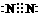 (2分)
(2分)
(2)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O (2分)
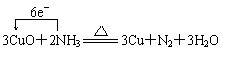 (3)4OH- -4e- =2H2O+O2↑ (或2H2O-4e-=4H++O2↑)(2分)
(3)4OH- -4e- =2H2O+O2↑ (或2H2O-4e-=4H++O2↑)(2分)
(4) (2分)
(5)1∶2(2分)
21.(6分)(1)H2 (1分)(2)SiO2 (Si3N4、AlN)(1分,写出任一化学式都得1分)
(3) Cl2+S2-=2Cl-+S(2分) (其它答案合理也给分,但要是离子方程式)
(4)Be(OH)2+2NaOH === Na2BeO2+2H2O (2分)
20.(12分)
Ⅰ①④(对1个得2分,有错不给分,共4分)
Ⅱ⑴乙(2分) ⑵A、C(各1分) 玻璃棒、烧杯(各1分) ⑶②(2分)
19. ⑴_ 0.03 _ mol/(L·min)
⑵①平衡 ;大于 。
②__ d _____(单选),
__ a ________(单选)。
9.B 10.B 11 D 12.A 13. B 14. C 15. D16.B17.A18.C
1.C 2.C 3.D 4.D 5.A 6.D 7.D 8.C
24.(10分) 将2molSO2和1molO2混合置于一定体积、压强的密闭容器中,在一定温度下发生如下反应:
2SO2(g)+O2(g) 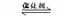 2SO3(g),△H < 0,当反应进行到时间t1点时达到平衡状态,测得混合气体总
2SO3(g),△H < 0,当反应进行到时间t1点时达到平衡状态,测得混合气体总
物质的量为2.1 mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为 。
(2)保持压强恒定,体积可变:
若在t1时充入一定量的氩气(Ar),SO2的物质的量将 (填“增大”、“减小”或“不变”);若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量将 2.1mol(填“<”、“>”或“=”),
(3)保持恒温恒容的条件下:
若在t1时充入一定量的氩气(Ar),SO2的物质的量将 (填“增大”、“减小”或“不变”);若在t1时再加入0.2molSO2、0.1molO2 和1.8molSO3,重新达到平衡状态时,SO2的转化率将(填“增大”、“减小”或“不变”)。
化学练习题
2006-12-18
23.(8分)I. 叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质。
(1)NaN3中存在的化学键有_ _(答案可能不止一个,填字母)。
a.离子键 b.极性共价键 c.非极性共价键
(2)3mol NaN3受撞击会生成4mol 氮气和一种离子化合物A,可用于汽车保护气囊。请写出有
关反应的化学方程式 ____ 。
Ⅱ.已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X元素原
子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下
均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
⑴仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的
离子方程式为_ 。
⑵这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),该化合物的
水溶液与足量的NaOH溶液反应的离子方程式为: 。
22. (10分) A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色, C的盐溶液通常为蓝色。它们之间有如下转化关系(其中反应③④⑦的产物中还有水):
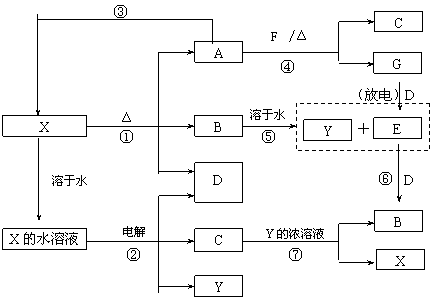
请回答下列问题:
⑴写出G分子的电子式: ;
⑵写出反应⑦的离子方程式是: ;
⑶写出电解X溶液的阳极反应式: ;
⑷写出反应④的化学方程式并标出电子转移情况: ;
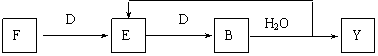 ⑸若使F按下列途径完全转化为Y:
⑸若使F按下列途径完全转化为Y:
则参加反应的F与整个过程中消耗D的物质的量之比为 。
21. (6分) 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
1 |
|
|
|
|
|
|
|
|
2 |
‚ |
ƒ |
|
|
„ |
… |
|
|
3 |
|
|
† |
‡ |
|
ˆ |
‰ |
(1)由上述元素形成的单质,熔沸点最低的是(写化学式,下同) ;形成的化合物可构成原子晶体的是 。
(2)列举事实用离子方程式说明⑨的非金属性强于⑧: 。
(3)除同族元素外,某些不同族元素的性质也有一定的相似性,如元素③与元素⑥的氢氧化物有相似的性质。试写出元素③的氢氧化物与NaOH溶液反应的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com