
题目列表(包括答案和解析)
27.(10分)医药安全问题是关系大众健康的重要问题。2006年5月25日《羊城晚报》披露,某药厂假“亮菌甲素”在中山大学附属第三医院已经造成9人死亡。被某药厂用来替代“丙二醇(CH3CH(OH)CH2OH)”生产“亮菌甲素”注射液的工业溶剂“二甘醇”有剧毒,外涂在烧伤病人皮肤上就能致命。
(1)二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式是HO-CH2CH2-O-CH2CH2-OH,下列有关二甘醇的叙述正确的是
A.能发生消去反应 B.能发生取代反应
C.能溶于水,不溶于乙醇 D.符合通式CnH2nO3
(2)工业上用乙二醇和环氧乙烷除了可制得二甘醇外还可得到一系列化合物,所得产物叫多缩乙二醇醚,可以做农药的乳化剂,也是良好的溶剂。
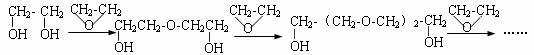
①以乙烯为原料生产环氧乙烷,经典的方法是氯代乙醇法,该方法包括两步反应,总的反应方程式可表示为: CH2=CH2
+ Cl2 + Ca(OH)2 → CaCl2 + H2O + 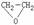 。
。
请写出第一、二步的化学反应方程式
第一步 , 第二步 ;
现代石油化工采用银作催化剂,可以实现一步完成,请写出该反应的化学方程式
。
②“绿色化学”是当今社会提出的一个新概念。在绿色化学中,一个重要的衡量指标是原子利用率,其计算公式为:原子利用率=期望产物的总质量与生成物的总质量之比
试计算两种生产工艺的原子利用率:氯代乙醇法生产环氧乙烷的原子利用率是 (取小数后一位);现代石油化工采用银作催化剂生产环氧乙烷的原子利用率是 。
③生成的多缩乙二醇醚 (填“是”或“否”)互为同系物,该系列物质碳元素质量分数的最大值为 。
《有机化学基础》模块试题(10分)
26.(9分)(1)某温度下,密闭容器中,发生如下可逆反应:2E(g)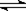 F(g)+x G(g);ΔH<0。若起始时E浓度为a mol·L-1 ,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1 ;若E的起始浓度改为2a mol·L-1 ,F、G浓度仍为0。当达到新的平衡时,①若x=l,容器体积保持不变,新平衡下E的体积分数为 ; ② 若x=2,容器体积保持不变,新平衡下F的平衡浓度 0.5a mol·L-1 (填 “>”
“<” “=”)。
F(g)+x G(g);ΔH<0。若起始时E浓度为a mol·L-1 ,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1 ;若E的起始浓度改为2a mol·L-1 ,F、G浓度仍为0。当达到新的平衡时,①若x=l,容器体积保持不变,新平衡下E的体积分数为 ; ② 若x=2,容器体积保持不变,新平衡下F的平衡浓度 0.5a mol·L-1 (填 “>”
“<” “=”)。
(2)t℃ 将3 mol A气体和1 mol B气体通入2 L固定体积的密闭容器中,发生如下反应:3A(g)+
B(g)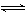 X C(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4 mol·L-1;请填写下面空白:
X C(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4 mol·L-1;请填写下面空白:
① 从开始反应至达到平衡状态,生成C的平均反应速率为 ,X= ;
② 若继续向原平衡混合物中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡
将 移动;
③若向原平衡混合物的容器中再充入amolC,在t℃达到新的平衡,此时B的物质的量为
n(B)= mol;
④如果上述反应在相同温度和容器中进行,欲使反应达到平衡时物质的量分数与原平衡时相同,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系为 。
25.(10分)短周期的四种元素A、B、C、D,原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两元素原子最外电子层上电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A和C可以形成化合物CA3;B与D的原子序数之比为3:4。
请回答:
(1)写出下列元素的元素符号:A ; B ; C ; D 。
(2)由四种元素中的三种组成的甲、乙两种化合物,甲属于盐类,其溶液呈酸性,甲的化学式是 ,请用离子方程式表示其水溶液呈酸性的原因 ;
乙为常见的天然高分子化合物,写出该高分子化合物在催化剂作用下完全水解的化学方程式: 。
(3)丙、丁两种化合物,它们均含上述四种元素,既可以与盐酸反应又可以与NaOH溶溶液反应,丙为无机盐,其化学式为 ,丁为有机物,且是同类有机物中相对分子质量最小的,其结构简式为 。
(4)A和B组成的化合物M,分子中A与B的原子个数比是3:1,常温常压下,0.5mol M完全燃烧放出780KJ的热量,请写出表示M燃烧热的热化学方程式:
。
24.(11分)2006年8月末,甘肃省徽县水阳乡有373名儿童被诊断为重度铅中毒。国家环保总局派出专家调查认为,水阳乡新寺村旁的一家铅锭冶炼厂是“罪魁祸首”, 铅锭冶炼厂周边土地已全部被污染。《东方时空》、《焦点访谈》专门对此做了报道,血铅超标的病人正在接受有效治疗。
(1)铅位在周期表的 周期 主族,已知+2价铅比+4价铅稳定,即+4价铅有较强的氧化性。
将PbO2与浓盐酸加热产生黄绿色的气体,写出该反应的化学方程式 ,
将SO2通入棕色PbO2的悬浊液会产生白色沉淀,写出该反应的化学方程式 。
(2)铅在自然界主要以方铅矿(PbS)存在,锭冶炼厂主要采用火法冶炼铅,其主要过程是先煅烧方铅矿制氧化铅,再用CO还原氧化铅制铅。请写出上述过程有关的化学方程式 , 。
(3)铅蓄电池是最常见的二次电池,它的正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质是H2SO4溶液。请写出电池放电时总反应式 ,放电过程中电解质溶液H2SO4的浓度将变 (填变大、变小或不变),当外电路通过2mol电子时,理论上负极板的质量增加 g。
(4)汽车工业为提高发动机的使用寿命,常在汽油中加入抗震剂四乙基铅,写出四乙基铅的分子式 。近年来我国许多城市禁止汽车使用含铅汽油,其主要原因是 。
23.(12分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
Ⅰ.(1) 该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)。
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______,反应的离子方程式为______________________________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ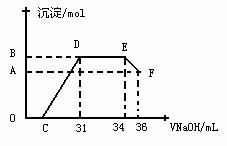 . 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1) 图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________ _______。
(2) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____ ___;
上述现象说明溶液中 、 、_______结合OH-的能力比________强(填离子符号)。
(3) B与A的差值为_________mol。
22.(10分)[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备[(NH4)2SO4·FeSO4·6H2O]。 实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得[(NH4)2SO4·FeSO4·6H2O]。
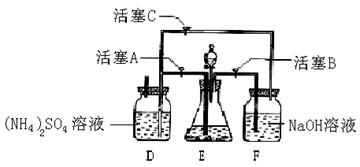
试回答下列问题:
(1)用Fe屑和稀H2SO4反应产生的氢气赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,其目的是 ;操作时应先关闭活塞 ,并同时打开活塞 ;
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用 。
(2)使[(NH4)2SO4·FeSO4·6H2O]结晶的实验操作是:将硫酸亚铁溶液与硫酸铵溶液的混合液转移至蒸发皿中, ,得到[(NH4)2SO4·FeSO4·6H2O]晶体。
(3)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
21.(8分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将pH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.附着于试管内壁上的硫,可用热碱液洗涤
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
(2)下列实验没有错误的是 。
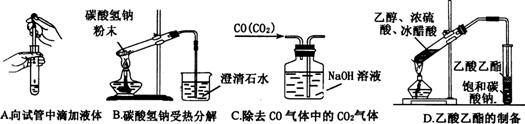
(3)下图为常见仪器的部分结构(有的仪器被放大)
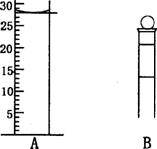
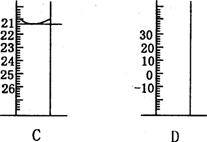
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。
20.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
 A B
C D
A B
C D
18. 已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向lL0.2 mol·L-1HF溶液中加入1L0.2 mol·L-1CaCl2溶液,则下列说法中正确的是
A.25℃时,0.1 mol·L-1HF溶液中pH=l
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生
D.该体系中,Ksp(CaF2)=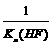
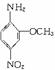
 19.2-氨基-5硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式为:
。
19.2-氨基-5硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式为:
。
若分子式与红色基B相同,且氨基( -NH2)与硝基(-NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能有
A.2种 B.4种 C.6种 D.10种
17.
锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( 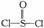 )中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,下列叙述中正确的是
)中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,下列叙述中正确的是
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com