
题目列表(包括答案和解析)
25.(10分)工业生产粗硅的主要原理为:SiO2 + 2C 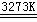 Si(粗)
+2CO↑
Si(粗)
+2CO↑
⑴若在制粗硅的过程中同时生成了碳化硅,且二者物质的量之比为1∶1,则参加反应的C和SiO2的质量比为 。
⑵工业上可通过以下原理由粗硅进一步制纯硅:
Si(粗)
+ 2Cl2(g) 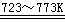 SiCl4(l) SiCl4 + 2H2
SiCl4(l) SiCl4 + 2H2
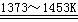 Si(纯)
+ 4HCl
Si(纯)
+ 4HCl
若上述反应中Si(粗) 和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂多少吨?
⑶工业上还可以通过如下图所示的流程制取纯硅:
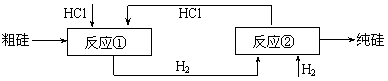
反应①:Si(粗)
+ 3HCl(g) 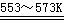 SiHCl3(l) + H2(g)
SiHCl3(l) + H2(g)
反应②:SiHCl3 + H2 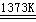 Si(纯)
+ 3HCl
Si(纯)
+ 3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①HCl中的利用率为75%,反应②中和H2的利用率为80%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是多少?
24.(8分)市场出售的某种品牌食品用发酵粉,实际上是由小苏打与一种有机酸式盐(不含结晶水)等物质的量混合物而成。
取一定量发酵粉溶于足量水中,两种酸式盐恰好完全反应,生成标准状况下的二氧化碳气体4.48L,将溶液蒸干并干燥,得到一种正盐R,其质量为42g。对此正盐进行下列实验:①用洁净的铂丝蘸取少许R,在无色火焰上灼烧,火焰呈黄色,再通过蓝色钴玻璃又见到紫色火焰;②经过元素分析仪测定,R中的碳、氢、氧的质量分数分别为22.86%、1.90%、45.71%;③光谱分析可知R中含有两个羟基,且不含亚甲基(CH2)。
试回答下列问题:
⑴正盐R中所含的金属元素是 ,R的物质的量为 。
⑵发酵粉中有机酸式盐的结构简式为 。
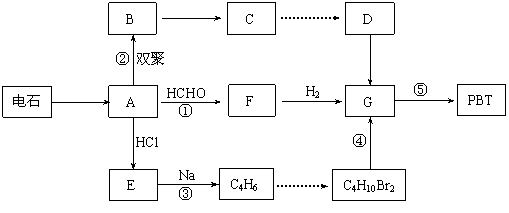
23. (10分) 生产工程塑料PBT(
)的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。
(10分) 生产工程塑料PBT(
)的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。
请你结合下列所给有关信息,回答问题。
Ⅰ.CH2=CH-CH=CH2与Br2的CCl4溶液发生1∶1加成可得到BrCH2-CH=CH-CH2Br和BrCH2-CHBr-CH=CH2二种产物。
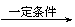
 Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅲ.
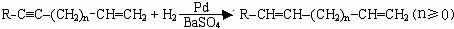 Ⅳ.
Ⅳ.
⑴写出E和F的结构简式: 、 。
⑵写出反应⑤的化学反应方程式: 。
⑶请你设计出由B→C…→D的反应流程图(有机物用结构简式表示,必须注明反应条件)。
 提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:

 B C
…… G
B C
…… G
22.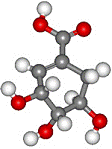 (8分)医学研究成果显示,从八角茴香中提取到的莽草酸具有抗炎、镇痛作用,是合成某些抗癌药物的中间体。莽草酸的分子结构模型如图所示(分子中只有C、H、O三种原子)。
(8分)医学研究成果显示,从八角茴香中提取到的莽草酸具有抗炎、镇痛作用,是合成某些抗癌药物的中间体。莽草酸的分子结构模型如图所示(分子中只有C、H、O三种原子)。
请回答下列问题:
⑴观察右图分子结构模型,写出莽草酸分子中能发生取代反应的官能团的名称_____________________。
⑵莽草酸跟有机物A在一定条件发生酯化反应,可生成一种相对分子质量为188的酯类物质。A的结构简式为_____________。
⑶莽草酸在一定条件下可以发生消去反应,能生成一种芳香族化合物,写出该物
质的结构简式 。
⑷环状有机物B是莽草酸的同分异构体,1mol该有机物与足量的银氨溶液反应生成4mol金属银;1mol该有机物与足量的金属钠反应生成1.5molH2。试写出符合上述条件的有机物B的结构简式________________________(写一种)。
21.(10分)近年来,镁在汽车、航天、航空、机械制造、军事等产业中应用迅猛发展。
 ⑴新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,是由于镁合金具有
等优异性能。
⑴新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,是由于镁合金具有
等优异性能。
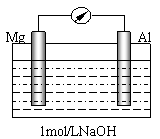
⑵某研究性学习小组探究以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池(如右图所示)时发现,刚开始,电表指针向右偏转,镁条做负极;但随后很快指针向左偏转,镁条表面有极少量的气泡产生。
①开始阶段,负极发生的反应是 。
②随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-=H2↑+2OH-,试写出镁电极发生的主要反应的极反应式______________________。
⑶经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如右图所示,溶液中的产物有Mg(NO3)2,NH4NO3和H2O。某同学拟用1.2g镁与100mL硝酸反应制取二氧化氮,硝酸的物质的量物质的量浓度至少为 。
20.(10分)由短周期元素组成的10种物质A-J间有下图所示的转化关系。已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成。试回答:
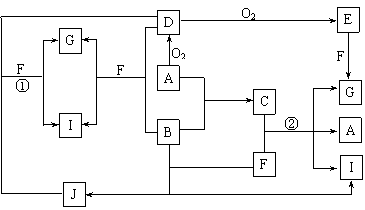
⑴工业生产中实现“D+O2 → E”转化的设备是 。
⑵反应①的离子方程式为 。
⑶足量铁与G的热的浓溶液反应所得气体是 。
⑷在一定条件下,9g液态F吸收49gE气体生成液态G时放出热量65.15kJ,则表示该反应的热化学方程式为 。
⑸C是一种重要的化工产品,为易挥发樱桃红色液体。若反应②中G和A的物质的量之比为1∶2,则C的电子式为 。
19.(8分)下表是元素周期表中第一、第二周期10种元素的某种性质的一组数据(数据单位相同)。除带“……”的四种元素除外,其余元素都给出了该种元素的全部数据。
|
(H) 13.6 |
|
|
|
|
|
|
(He) 24.6 54.4 |
|
(Li) 5.4 75.6 122.5 |
(Be) 9.3 18.2 153.9 217.7 |
(B) 8.3 25.2 37.9 259.4 340.2 |
(C) 11.3 24.4 47.9 64.5 392.1 489.9 |
(N) 14.5 29.6 47.4 72.5 97.9 552.1 …… |
(O) 13.6 35.1 …… …… …… …… …… |
(F) 17.4 34.9 …… …… …… …… …… |
(Ne) 21.6 41.6 …… …… …… …… …… |
⑴每组数据可能是该元素的 。
A.原子得到电子所放出的能量 B.单质在不同条件下的熔、沸点
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径大小
⑵稀有气体元素的第一个数据较大的原因是__________________________________;请你推测镁和铝的第一个数据的大小Mg_____Al。
⑶同一元素原子的一组数据中,有的数据增大特别多,形成突跃,这些数据出现的规律,说明原子结构中 。
18.(12分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为 ;
乙同学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
……
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是 。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是: ;
②实验③中溶液变成血红色的离子方程式为 。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-小外,还有 。
17.(10分)为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。
⑴图一可通过观察 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。

图一 图二
⑵检查图二装置气密性的方法是
。图二所示实验中需测量的数据是 。
16.某研究小组研究了其他条件不变时,改变条件对以下可逆反应的影响:
2SO2(g)+O2(g) 2SO3(g);△H<0
2SO3(g);△H<0
下列说法正确的是

图一 图二 图三 图四
A.图一研究的是温度、压强对平衡的影响,横坐标表示压强
B.图二研究的是温度对平衡的影响,Ⅱ采用的温度更高
C.图三中t0时使用了催化剂,使平衡向正反应方向进行
D.图四中t0时增大压强,使平衡向正反应方向进行
第二卷(非选择题 共86分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com