
题目列表(包括答案和解析)
4.下列说法中,错误的是
A. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
B. 0.5 mol Ba(OH)2与0.5 mol H2SO4完全反应生成BaSO4沉淀时放出的热叫做中和热
C. △H>0表示吸热反应,△H<0表示放热反应
D. 热化学方程式中的化学计量数表示物质的量,可以是分数
3.下列有关物质的表达式错误的是
A. 甲醛的结构式 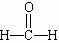
B. 乙烷的结构简式 CH3CH3
C. 葡萄糖的分子式 CH2OH(CHOH)4CHO
D. 过氧化氢的电子式 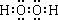
2.下列说法错误的是
A. 血液中的血细胞直径在1-100nm之间,所以血液是胶体
B. 糖类是具有甜味的物质
C. 碘和干冰升华时,克服的粒子间作用属于同一类型
D. 氯化铵的水解反应可看作是盐酸与氨水反应的逆反应
1.下列说法错误的是
A. 乙醇分子中-OH与水分子中-OH相近,因此乙醇与水有些性质相似
B. 生命体中许多大分子内存在氢键,如DNA的两个螺旋链是用氢键相互结合的
C. 1个苯分子中,存在3个碳碳双键和3个碳碳单键
D. 卤族元素原子中,与氢原子形成最强极性键的原子是氟原子
26、(12)已知常温时反应2Fe3+ + Cu === 2Fe2+ + Cu2+在水溶液中能够发生,将22.4g 由铜和三氧化二铁组成的混合物粉末加入到浓度为1mol/L的硫酸中发生相应的反应。
(1)若固体恰好完全溶解,消耗硫酸的体积为V,求V的取值范围。(6分)
(2)若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中的浓度为,求原混合物中含铜多少克?(7分)
25、(8分)常温下,有PH=12的NaOH溶液100mL,若将其PH变为11,(设溶液的体积可直接相加,计算结果保留小数点后一位)
(1)若用PH=10的Ba(OH)2溶液,应加入 mL。
(2)若用PH=2的盐酸,应加入 mL。
(3)若用0.01mol/L的CH3COOH溶液V1mL,则V1的取值为 。
(填取值范围)
(4)若用PH=2的任意一元酸HR的溶液V2mL,则V2的取值为 。
(填取值范围)
24、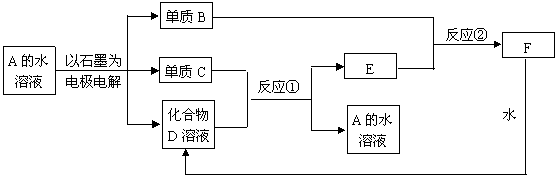 (7分)下图中A~F均为中学化学中常见物质。它们之间的转化关系如下:
(7分)下图中A~F均为中学化学中常见物质。它们之间的转化关系如下:
(1)若反应①和②不需要特定的反应条件就能进行,则单质B是 ,化合物D是 ,电解一段时间后,原溶液的PH (填“增大”“减小”或“不变”)
(2)若反应①和②需要在一定的条件下才能进行,则电解A溶液的化学反应方程为: 。C与D的稀溶液不反应,但若通入B气体或用D的浓溶液,在加热条件下可以反应生成A溶液,写出这一反应的化学方程式:
。
23、(10分)“化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只控制第一个反应,就好像多米诺骨牌游戏一样,下图就是一个“化学多米诺实验”在实验过程中的装置图。
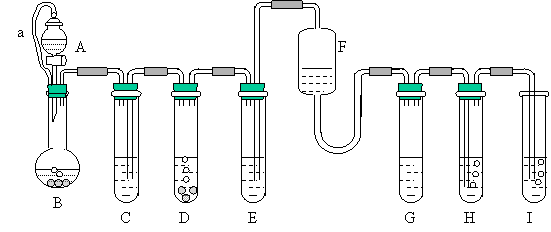
各装置中试剂或物质是:(A) 2mol/LH2SO4 (B) Zn (C) 2mol/H2SO4+CuSO4 (D) Zn (E) CuSO4溶液 (F) NH3·H2O (G)30%H2O2 (H) 饱和H2S溶液 (I) NaOH溶液。
已知:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O该反应产物可作为H2O2分解的催化剂。
请回答下列问题:
(1)进行实验前必须进行的操作是 。
(2)反应过程中B与D两容器中反应速率比较B D(填<、>、=),原因
是 。
(3)H中的现象是 。
(4)I中可能发生的反应的化学方程式 。
(5)A和B之间导管a的作用是 。
(6)在该实验中不涉及的反应类型是(填序号) 。①分解反应 ②化合反应 ③置换反应 ④复分解反应。
22、(5分)已知某溶液中只存在OH-、H+、CH3COO-、Na+、,推测其离子浓度大小顺序有如下四种关系:
① C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
② C(Na+)>C(CH3COO-)>C(H+)>C(OH-)
③ C(CH3COO-)>C(Na+)>C(H+)>C(OH-)
④ C(Na+)>C(OH-)>C(CH3COO-)>C(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填编号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为C(NaOH) C(CH3COOH)(选填 >、<或 =,下同),混合前酸中的C(H+)和碱中的C(OH-)的关系是:
C(H+) C(OH-)
21、(3分)下列实验中所选仪器或操作不合理的是 。
A、用托盘天平称量11.5g 氯化钠晶体。
B、用碱式滴定管量取25.00mL溴水。
C、用瓷坩埚灼烧各种钠的化合物。
D、测溶液的PH时,用洁净、干燥的玻璃棒醮取溶液,滴在用蒸馏水润湿的PH试纸上,再与标准比色卡比较。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com