
题目列表(包括答案和解析)
7.某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是 ( )
A.利用了SO2的水溶性,将SO2直接通入水中
B.利用了SO2的氧化性,将SO2直接通入水中
C.利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
6.下列气体溶解于水,没有发生氧化还原反应的是 ( )
A.SO2溶解于水 B.NO2溶解于水 C.CO2溶解于水 D.Cl2溶解于水
5、在常温常压下,下列各组气体不能共存的是 ( )
A.SO2与O2 B.NO2与NO C.O2与N2 D.NO与O2
4.某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是 ( )
A.利用了SO2的水溶性,将SO2直接通入水中
B.利用了SO2的氧化性,将SO2直接通入水中
C.利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
3.酸雨给人类带来了种种灾祸,严重地威胁着地球生命生存的生态环境,下列有关减少或者防止酸雨形成的措施中可行的是 ( )
①对燃煤进行脱硫;②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中;③
人工收集雷电作用所产生的氮的氧化物;④飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等。
A.①②③④ B.①②③ C.①②④ D.①③④
2、飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2和O2
接触时,SO2会部分转化为SO3,使空气的酸度增加,环境污染更为严重。其中飘尘所起的作用可能是:
A.氧化剂 B.还原剂 C.催化剂 D.载体
1.下列污染现象主要与SO2有关的是 ( )
A.臭氧空洞 B.酸雨 C.光化学烟雾 D.温室效应
3、NO和O2同时通入水中时,此时的反应为:4NO+3O2+2H2O=4HNO3
当V(NO) ∶V(O2)

典例剖析
[例1]北京市最近规定进京汽车尾气排放必须符合国家标准。因为汽车尾气(含烃类、CO、SO2与NO等有毒气体)是城市空气的污染源。治理的方法之一是在汽车的排气管上,装一个催化转换器(用Pt、Pd合金作催化剂),它的特点是使CO和NO反应,生成参与大气生态循环的无毒气体,并使汽油充分燃烧及SO2转化。 (1)写出NO和CO通过催化转换器发生反应的化学方程式: (2)“催化转换器”的缺点是在一定程度上提高了空气的酸度。其原因是: (3)控制城市空气污染源的方法有: a.植树造林 b.开发氢能源 c.使用非机动车 d.控制汽车进城 e.使用无铅汽油
解析:一辆以汽油为燃料的汽车有几个地方排出污染物,其中最主要的是尾部排出的废气。废气中主要含CO、NOx及碳氢化合物。CO是汽油不完全燃烧的产物,NOx是汽油爆裂时,进入的空气中氮和氧化合而成。碳氢化合物中含有烷烃、烯烃和芳烃、醛等,有的是汽油原有成分,有的是氧化产物。让学生明确汽车尾气成分有利于认识尾气对环境的污染,有利于要治汽车尾气。大城市中汽车多,大气中NO含量较高这是因为,汽车引擎在工作时产生高温高压使之发生如下反应:N2+O2=2NO,矿物油中硫在燃烧过程中产生SO2,不完全燃烧产生CO,治理方法是在汽车排气管上装一个用铂、钯合金作的“催化转化器”,使之发生反应,NO与CO反应生成N2和CO2,SO2催化氧化为SO3。控制城市空气污染源的根本方法是植树造林和开发无污染的氢能源。
答案:(1)2CO+2NO N2+2CO2 2SO2+O2
N2+2CO2 2SO2+O2 2SO3 (2)反应除生成了N2外,还生成了增加空气酸度的CO2和SO3 (3)a、b
2SO3 (2)反应除生成了N2外,还生成了增加空气酸度的CO2和SO3 (3)a、b
[例2]虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体
产物,填写下列空白:
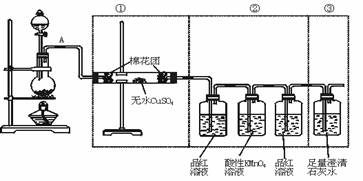
(1)如果将装置中①②③三部分仪器的连接顺序变为②①③,则可以检出的物质是______;不能检出的物质是______。
(2)如果将仪器的连接顺序变为①③②,则可以检出的物质是______;不能检出的物质
______。
(3)如果将仪器的连接顺序变为 ②③①,则可以检出的物质是______;不能检出的物
______。
解析:要正确解答本题务必清楚题给实验装置各部分的作用及排列顺序不可变更的原因.装置①为检验产物H2O,只能放在装置②③之前,因为若放在装置②③之后或装置②③之间,则气流通过装置②或③一定要带出水蒸气,则无法验证使CuSO4变蓝的水蒸气是否是反应生成物.装置③和装置②位置也不得变更,因为SO2、CO2均能使澄清石灰水变浑浊.故
验证CO2前一定要排除SO2的干扰。答案:(1)SO2、CO2 H2O (2)SO2 CO2 (3)SO2、CO2 H2O
知能训练
2、NO2和O2的混合气体溶于水时,根据反应:4NO2+O2+2H2O=4HNO3
当V(NO2)∶V(O2)

1、NO2或NO2与N2(非O2)的混合气体溶于水时,可根据反应:3NO2+H2O=2HNO3+NO,利用气体
体积的变化差值进行计算.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com