
题目列表(包括答案和解析)
4.用pH试纸测定某氨基酸溶液的pH,如果先将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,溶液pH的测得值为8,则该氨基酸溶液的实际pH( )
A.大于8 B.小于8 C.等于8 D.小于7
3.短周期元素形成的难电离物质中,前者加酸和加碱都能抑制其电离、后者加酸和加碱都能促进其电离的是( )
A.水 醋酸 B.醋酸 一水合氨 C.水 氢氧化铝 D.一水合氨 苯酚
2.(2005全国)相同体积的pH =3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是 ( )
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较两者产生氢气的量
1. (2005上海)欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3¯)都减少,其方法是
A、通入二氧化碳气体 B、加入氢氧化钠固体
C、通入氯化氢气体 D、加入饱和石灰水溶液
15. (12分)已知:KMnO4、MnO2在酸性条件下均能将草酸钠氧化,Mn元素均被还原为Mn2+。某研究小组为测定软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品置于一烧杯中,加入2.68g草酸钠固体,再加入过量的稀硫酸并加热(杂质不参加反应并且不溶于酸),充分反应后冷却、滤去杂质,将所得溶液全部转移到100mL容量瓶中并定容后备用;准确量取20.00mL 0.0400mol·L-1的KMnO4标准溶液置于锥形瓶中,再从容量瓶中取出部分溶液置于一洁净且不漏水的滴定管中进行滴定,当滴入25.00mL待测液时恰好完全反应。请回答下列问题:
(12分)已知:KMnO4、MnO2在酸性条件下均能将草酸钠氧化,Mn元素均被还原为Mn2+。某研究小组为测定软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品置于一烧杯中,加入2.68g草酸钠固体,再加入过量的稀硫酸并加热(杂质不参加反应并且不溶于酸),充分反应后冷却、滤去杂质,将所得溶液全部转移到100mL容量瓶中并定容后备用;准确量取20.00mL 0.0400mol·L-1的KMnO4标准溶液置于锥形瓶中,再从容量瓶中取出部分溶液置于一洁净且不漏水的滴定管中进行滴定,当滴入25.00mL待测液时恰好完全反应。请回答下列问题:
⑴ 写出MnO2氧化草酸钠的离子方程式 ;
⑵ 将MnO2氧化草酸钠后的溶液全部转移到100mL容量瓶中的具体操作是 ;
⑶ 从容量瓶中取出的部分溶液应置于 (选填“A”或“B”)滴定管中;滴定前必须进行的操作是 ,滴定过程中是否需要指示剂 (选填“是”或“否”),若回答“是”,请写出指示剂的名称;若回答“否”,请写出判断滴定终点的依据 ;
⑷ 你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”),若回答“能”,请求出计算结果;若回答“否”,请说明原因 。
14、对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。
若25℃时有HA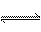 H++A-,则K==
H++A-,则K==
式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1==4.31×10-7 K2==5.61×10-11 |
|
H2S |
H2S H++HS- H++HS-HS-  H++S2- H++S2- |
K1==9.1×10-8 K2==1.1×10-12 |
|
H3PO4 |
H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HP42-  H++PO43- H++PO43- |
K1==7.52×10-3 K2==6.23×10-8 K3==2.20×10-13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?_____________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是__________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________________,产生此规律的原因是___________________________________。
13、已知氢氧化镁饱和溶液中存在下列平衡,且Mg2+和OH-的物质的量浓度存在下列关系:c(Mg2+)• c(OH-)2=Ksp,Ksp是一常数。
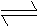 Mg(OH)2 (s)
Mg2+(aq)+2OH-(aq)
Mg(OH)2 (s)
Mg2+(aq)+2OH-(aq)
某学生在toC下用纯水制备了一份氢氧化镁饱和溶液,测得溶液的pH为10。
(1)用上述测定数据计算在toC时氢氧化镁的溶解度(用mol·L-1单位表示)。
(2)计算在toC氢氧化镁的Ksp。
(3)计算toC时在0.010 mol·L-1 NaOH中氢氧化镁的溶解度(用mol·L-1单位表示)。
(4)toC下将10g Mg(OH)2和100mL 0.100 mol·L-1 HCl的混合并充分搅拌,计算该混合体系中达平衡时溶液的c(OH-)。
12、(1)某温度时,水的离子积为K =1×10
=1×10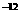 ,将此温度下pH=10的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得溶液的pH=6,则a:b=__________,此溶液中各种离子的浓度由大到小的排列顺序是____________________。
,将此温度下pH=10的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得溶液的pH=6,则a:b=__________,此溶液中各种离子的浓度由大到小的排列顺序是____________________。
(2)已知某溶液中只含有四种离子:A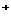 、B
、B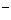 、H
、H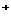 、OH
、OH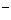 ,对这四种离子浓度的大小比较,有以下三种顺序。在你认为正确的顺序后面的空格内填写由A
,对这四种离子浓度的大小比较,有以下三种顺序。在你认为正确的顺序后面的空格内填写由A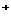 和B
和B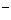 组成物质的化学式(只写一种情况即可);在你认为不正确的顺序后面的空格内填写不正确的原因。供选择的离子有:
组成物质的化学式(只写一种情况即可);在你认为不正确的顺序后面的空格内填写不正确的原因。供选择的离子有:
Na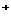 、Ag
、Ag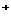 、NH
、NH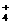 、Cl
、Cl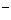 、NO
、NO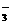 、CH
、CH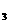 COO
COO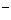 、H
、H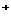 、OH
、OH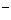
①
c(B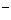 )>c(A
)>c(A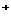 )>c(H
)>c(H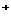 )>c(OH
)>c(OH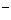 ):______________________________。
):______________________________。
②
c(A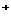 )>c(B
)>c(B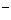 )>c(OH
)>c(OH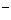 )>c(H
)>c(H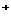 ):______________________________。
):______________________________。
③
c(H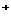 )>c(B
)>c(B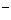 )>c(A
)>c(A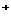 )>c(OH
)>c(OH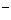 ):___________________________________。
):___________________________________。
11、某温度下,水的离子积为Iw=1×10一12,则该温度 (填“<”、“>”、“=”)25℃,若将该温度下pH=11的Ba(OH)2溶液aL和pH=l NaHS04bL混和(设混和过程中的体积变化忽略不计),试填写下列空格.
(1)若所得溶液为中性,则a:b= ,此时,溶液的pH=
(2)若所得溶液pH=2,则a:b= ,此时,溶液中所含的主要离子
的浓度由大到小的顺序为
(3)若Ba2+和S042一恰好完全沉淀,a:b=
10、⑴常温下将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= mol/L;c(H+)-c(MOH)= mol/L。
⑵常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
⑶常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_________。(填“>7”、“<7”、或“无法确定”=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com