
题目列表(包括答案和解析)
1、三式:分子式:_____;电子式:_____结构式:_____。
21、 将0.050mol/L的盐酸与未知浓度的NaOH溶液以1∶2的体积比混合,所得溶液pH值为12.用上述NaOH溶液与某一元弱酸HA20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液pH值为10.
(1)试求一元弱酸HA的物质的量浓度;0.02mol/L
(2)盐类水解程度的大小可用“水解度(h)”来表示.对于NaA型盐的水解度(h)为:(已水解的物质的量/原来总物质的量)×100%.试求上述所得NaA溶液的水解度(h).
25%
20.(8分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
 H2A = H+ + HA-
HA-
H+ + A2-
H2A = H+ + HA-
HA-
H+ + A2-
回答下列问题:
(1) 用离子方程式表示Na2A溶液显“酸性”,“中性”,或“碱性”的原因
__________________________________________ __
(2) 在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1
B c(OH-)=c(H+) +c( HA-)+2c(H2A)
C c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-)
D c(Na+ ) 〉c(A2-) 〉c( HA-) 〉c(OH-) 〉c(H+)
(3) 常温下,已知0.1mol·L-1NaHA溶液的pH=2,则当H2A溶液中c(H+)为0.11 mol·L-1时,H2A溶液的物质的量浓度应___________ _;
比较①0.1mol·L-1 Na2A溶液 ②0.1mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小,简要说明你的判断方法___________________________________。
 答案:(1)A2-
+ H2O HA- + OH-
(2)C
(3)>0.1mol/L
答案:(1)A2-
+ H2O HA- + OH-
(2)C
(3)>0.1mol/L
(4)因为两溶液中c(Na+)相同,而c(H+)Na2SO4大于Na2A,根据电荷守恒,所以阴离子总浓度Na2SO4大于Na2A。
19. 已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得
混合液显酸性;0.01mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶
液与pH =12的NaOH溶液等体积混合,所得混合液显中性。请回答下列问题:
(1)高碘酸是 (填“强酸”或“弱酸”),理由是
。
(2)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的氧化剂是 ,反应的离子方程式可表示为:
。
答案:弱酸 理由略 高碘酸 5H5IO6+2Mn2+= 11H++2MnO4-+5IO3-+7H2O
18.常温下已知两种一元弱酸HX和HY,已知向NaX溶液中通入CO2气体只能生成HX和NaHCO3,往NaY溶液中通入CO2可以生成HY和Na2CO3。有关叙述正确的是
A.结合质子的能力: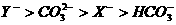
B.酸性由强至弱:H2CO3>HX>HY C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度: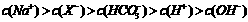
17. 已知反应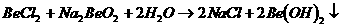 能完全进行,则下列推断中,正确的是( )
能完全进行,则下列推断中,正确的是( )
A. 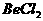 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B. 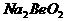 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C.  既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液
D. 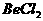 水溶液的导电性强,因此
水溶液的导电性强,因此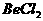 一定是离子化合物
一定是离子化合物
16. 常温下,0.1 mol·L-1某一元酸(HA)溶液中 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1 B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
15、已知HF酸性比HCN的酸性强,现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中所有离子数目为n1,后者的所有离子数目为n2,下列关系式正确的是
A.n1 = n2 B.n1 > n2 C.n1 < n2 D.C(F-) >C(CN -)
14.四种盐都是一元酸和一元碱反应生成的,实验测得盐AX和BY的水溶液pH都等于7,AY的水溶液pH>7,BX水溶液pH<7,下列结论正确的是
A.盐AX和BY没有发生水解,盐AY和BX发生了水解 B.酸性HX>HY,碱性AOH>BOH
C.等物质的量的AY和BX的混合物溶于水,溶液呈中性
D.等物质的量浓度的HX溶液和HY溶液的pH值前者大于后者
13.现有等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,下列说法中正确的是
A.若混合前三溶液pH相等,将它们同等倍数稀释后,NaOH溶液pH最大
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1>V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com