
题目列表(包括答案和解析)
6、能正确表示下列反应的离子方程式的是 ( )
A.小苏打溶液与醋酸反应:HCO3-+H +=====CO2↑+H2O
|
B.用铜作电极电解硫酸铜溶液:2Cu2++2H2O=====4H++2Cu+O2↑
C.饱和碳酸氢钙中加入过量的澄清石灰水:Ca2++HCO3-+OH-===CaCO3↓+H2O
D.硫化亚铁与稀硝酸反应:FeS + 2H + ===Fe2+ +H2S↑
5.室温下,强酸性和强碱性溶液中都能大量共存的离子组是 ( )
A、NH4+、Fe2+、Cl-、NO3- B、K+、Na+、SO32-、CO32-
C、K+、Na+、AlO2-、SO42- D、.Ba2+、Na+、NO3-、Cl-
4.国际化学组织已将周期表中原主、副族的族号去掉而改称列,如碱金属为第1列,稀有气体为第18列。按此规定,下列叙述中正确的是 ( )
A、第15列元素形成的RH3型化合物中自上至下熔沸点依次升高 。
B、第14列元素所形成的化合物种类最多
C、第17列元素均有最高价氧化物R 2 O7 ,
D、最外层有2个电子的原子都在第2列
3、正确掌握好化学用语是学好化学的基础,下列有关表述正确的是 ( )
A.CO2的分子模型:
B. NH3的结构式: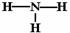
C.NH4Cl的电子式为: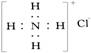
D.F原子结构示意图: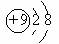
2、阿伏加德罗常数(NA)约为6.02×1023。下列叙述中不正确的是 ( )
A、标准状况下,22.4 L CO2和CO混合气体中含有的碳原子数约为6.02×1023
B、常温常压下,0.1 mol Fe在0.1 mol C12中充分燃烧,转移的电子数约为l.806×1023
C、31g白磷含有1.5NA个共价键
D、1 L l mol·L-1的NaHC03溶液中离子总数大于1.204×1024
1、下列说法正确的是 ( )
A、加碘食盐是在食盐中加入了碘单质。
B、市场上出现了各种各样的营养食盐,如:锌营养盐、钙营养盐 、硒营养盐、低钠营养盐、加碘食盐等十多种营养、保健盐;钙营养盐是在食盐中加入了氯化钙或碳酸钙等含钙的化合物
C、CO气体有毒,在生有炉火的居室中多放几盆水,可吸收CO。
D、绿色食品是指未使用过化肥和农药生产出来的农副产品
6.在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9kg氧气,呼出1.0kg二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。
方法一、有的科学家提出“金属过氧化物处理系统”,即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式是①_______________________②_______________________;将处理后的气体充入座舱时,应注意采取的一项措施是_______________________。
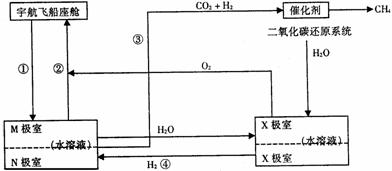 方法二、有科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下:
方法二、有科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下:
电化学二氧化碳处理系统 电解水系统
(1)管道①把飞船座舱中合较多二氧化碳的潮湿空气通入“电化学二氧化碳处理系统”的M极室,通过该电极反应可以使二氧化碳不断被吸收;该电极反应式为_______________,其电解产物吸收二氧化碳的离子方程式为____________________________________。在M极吸收二氧化碳后形成的离子会通过隔膜进入N极室,通过N极的电极反应可使二氧化碳从电解液中释放出来,并保持系统内的pH不变;该电极反应式为:__________
_____________________________________________,二氧化碳逸出的离子方程式为
___________________________________________________。
(2)管道②是将处理后的空气混入“电解水系统”产生的新鲜氧气,然后通入飞船座舱内供宇航员呼吸用。在“电解水系统”中,Y为____________极(填“阴”或“阳”),X极的电极反应式为_______________________。
(3)逸出的二氧化碳没有排出飞船外,而是通过管道③进入“二氧化碳还原系统”。在该系统内,二氧化碳跟氢气在一定条件下反应,其产物有甲烷等气体,请评价这样处理的重要意义_________________________________________________________________。
5.氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
|
|
|
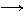 工业CuSO4
CuSO4溶液 CuSO4·5H2O …… CuO
工业CuSO4
CuSO4溶液 CuSO4·5H2O …… CuO
①步骤I的目的是除不溶性杂质。操作是 。
②步骤Ⅱ的目的是除铁元素。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是 。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是 ,过滤,水浴加热烘干。水浴加热的特点是 。
⑵探究氧化铜的性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A 和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡。结论是 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有:
。
4.钨是我国丰产元素 , 是熔点最高的金属 , 广泛用于拉制灯泡的灯丝 , 有“光明使者”的美誉。钨在自然界主要以钨 (+6价) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。 白钨矿的主要成分是钨酸钙 (CaW04); 黑钨矿的主要成分是铁和锰的钨酸盐 , 化学式常写成(Fe,Mn)W04。黑钨矿传统冶炼工艺的第一阶段是碱熔法 :
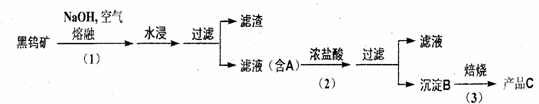
其中 A 、 B 、 C 都是钨的化合物。
(1) 写出上述流程中 A 、 B 、 c 的化学式。
A_________________ B_________________ C__________________
(2) 钨冶炼工艺的第二二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时 , 可用碳作还原剂。写出用碳还原氧化钨制取金属钨的化学方程__________________________________________________________________
为了获得可以拉制灯丝的高纯度金制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂 ,为什么 ?____________________________________________________
(3)仲钨酸的阱盐在热分解时会发生内在氧化还原反应 ,我国钨化学研究的奠基人顾冀东先生采用这一反应制得了监色的、非整比的钨氧化物 WO3-x。 这种监色氧化钨具有比表面大、易还原的优点 , 在制钨粉时温度容易控制 ,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析 , 得知蓝色氧化钨中钨的质量分数为 0.7985。
①计算 W03-x中的x值。X=__________________
②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这两种价态的钨原子数比。___________:___________
( 相对原子质量 : W: 183.84 0: 16.00)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com