
题目列表(包括答案和解析)
(四) 乙烯的化学性质
1.乙烯的氧化反应
a.可燃性:CH4 + O2 →
现象:
b.乙烯可使酸性高锰酸钾溶液褪色。
乙烯的C=C易被强氧化剂如KMnO4氧化而断裂,产物可能是CO2。现象:紫色褪去,以此反应可以区别乙烯和烷烃
2.乙烯的加成反应
CH2=CH2+Br-Br→______(1,2-二溴乙烷)
现象: 。反应实质:C=C断开一个,2个Br分别直接与2个价键不饱和的C结合。
加成反应: 。
练习:根据加成反应的特点,完成乙烯与H2、HCl、H2O反应的化学方程式:
__________、_____________、___________。
3. 聚合反应
________________的反应叫聚合反应。
聚合反应若同时也是加成反应,也叫_____反应,简称______反应。
写出氯乙烯聚合反应方程式:_______________, 丙烯聚合反应方程式:_____________。
(三) 乙烯的结构:分子式 ,电子式 ,结构式 结构简式 空间构型 。____________的烃叫烯烃。乙烯与乙烷结构的对比:
|
分子式 |
乙烷 |
乙烯 |
|
结构式 |
CH3-CH3 |
CH2=CH2 |
|
键的类别 |
C-C |
C=C |
|
键角 |
109o28' |
120o |
|
键长(10-10米) |
1.54 |
1.33 |
|
键能(KJ/mol) |
348 |
615 |
小结:乙烯的结构特点(1)乙烯是__结构,不能旋转,键角为__°(2) C=C不稳定:C=C易断裂而被氧化;C=C有一个键不稳定,容易断裂,有一个键较稳定.
(二) 乙烯的物理性质:乙烯是__色__气味的气体;__溶于水;密度较空气__,在标准状况下的密度为1.25g/L。
(一) 乙烯的制得
1. 石蜡油分解实验。现象:①生成的气体通入酸性高锰酸钾溶液中(和甲烷对比) ; ②生成的气体通入溴的四氯化碳溶液中 ;③用排水集气法收集到一试管气体,点燃后现象是 。研究表明,石蜡油分解的产物主要是 和 的混合物。
2. 乙醇与浓硫酸共热(170 °C)制乙烯
写出化学反应方程式: 。
 画出实验装置图:
画出实验装置图:
12、(13分)解热镇痛药非那西汀的合成路线:
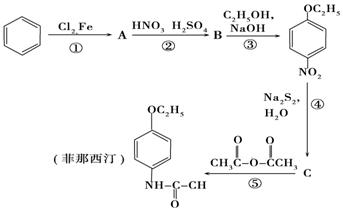
根据该合成路线,回答下面问题
(1)写出A、B、C的结构简式___________________________________________;
(2)写出反应⑤的化学方程式____________________________________________。
(3)请推测与化合物C是同分异构体,且苯环上只有2个取代基,并含有酚羟基和-NH2的
化合物有 种。
11、 .(15分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
.(15分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则 ①工业上反应I在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③反应I的化学方程式是 。
(1) 若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。 ③若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:
10、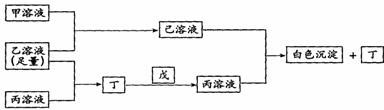 (14分)有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
(14分)有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
请回答:
(1)写出C元素的原子结构示意图__________,写出丁和戊的电子式________、_______;
(2)用有关化学用语解释:乙溶液呈酸性的原因________________________ ______;
丙溶液呈碱性的原因__________________________ ___;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______ __________________ ______;
②己溶液+丙溶液→丁_________ ___________________ __
9、(1)(6分)下列有关实验的叙述,正确的是(填序号)(少一个扣一分,多一个倒扣一分,扣完为止) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉溶液中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D).在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓硝酸洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H) 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(2)、(3分)有以下七种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(ClO)2:④CaCl2;⑤Na2CO3;⑥NaAlO2;⑦NH3和NaC1,分别持续通入CO2,最终能得到沉淀或析出晶体的是
(3)、(9分)混合物平均摩尔质量通常可表示为: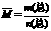 ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
①相同条件下,潮湿空气的密度 (选填“>”、“<”或“=”)干燥空气的密度,理由是: ;
②在一定条件下的密闭容器中,存在如下平衡:C(s)+H2O(g)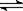 CO(g)+H2 (g);假如温度保持不变并加压,则
CO(g)+H2 (g);假如温度保持不变并加压,则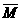 (混合气)将
(填写“变大”、“变小”或“不变”);
(混合气)将
(填写“变大”、“变小”或“不变”);
③以物质的量之比为1:2相混合的Na2SO3和K2SO3的混合物共a g,与足量盐酸反应生成的SO2物质的量n(SO2)= mol(用含a的代数式表示)。
8、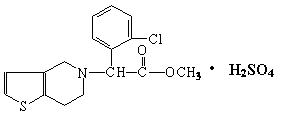 波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音。波立维属于硫酸氢盐,它的结构如图所示。下列关于它的说法正确的是
波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音。波立维属于硫酸氢盐,它的结构如图所示。下列关于它的说法正确的是
A.该物质的化学式为C16H15ClNO2·H2SO4 B.该物质不溶于水
C.波立维能和氢气反应,每摩最多可消耗3摩氢气
D.它可以与NaOH溶液反应,1mol该物质最多可消耗4molNaOH
7、对可逆反应4A(g)+5B(g)≒ 4C(g)+6D(g)△H<0,下列叙述中正确的是( )
A、化学反应速率关系是:3v正(A)=2v正(D)时达到平衡;
B、若单位时间内生成x mol C的同时,消耗x mol A,则反应一定处于平衡状态
C、达到化学平衡后,增大容器的容积,则正反应速率减小,逆反应速率增大
D、达到化学平衡后,升高温度,则C的质量分数减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com