
题目列表(包括答案和解析)
2、命题趋向:从近几年的高考看,碱金属的考查主要侧重于下列三个方面:钠及其化合物的性质推断、碱金属元素性质的比较、有关钠及其化合物的计算。预计今后的考题还会以该元素化合物知识为载体考查有关概念、理论、实验和计算。有关Na2O2的实验,NaHCO3与Na2O2、CO2与NaOH反应的计算将是重点。
有关Mg、Al、Fe的知识的试题在近几年的高考中出现次数很多,它们的离子共存、离子方程式、物质鉴别、制取、推断、计算等题型中大量出现,其中Mg与CO2反应,Mg3N2跟水反应、Mg(OH)2比MgCO3难溶能在推断题中应用,Al及Al2O3、Al(OH)3的两性,Al3+与CO32-双不解;Al3+、Al(OH)3、AlO2-间的转化是考试的热点;铁的变价、Fe(OH)2和Fe(OH3)炼铁的反应多与实验、推断、计算相结合,进行应用。试题形式多样、选择、简答、实验、推断、计算都有。
今后命题的方向主要集中在:铁三角,铝三角,Fe3+、Al3+与AlO2-的双水解,尤其是以Mg、Al、Fe及其化合物为主干的无机推断将仍是重点考查的内容。2006年高考估计上述题型、命题特点基本保持不变。
课堂训练:
1、 方法与技巧:
(1) 铁的化合物与亚铁的化合物间的相互转变
Fe只有还原性,可以被氧化成Fe2+和Fe3+,也可由Fe2+、Fe3+还原而得到Fe;Fe2+既具有氧化性又具有还原性,但主要表现为还原性,当遇到强氧化剂时,被氧化为Fe3+,遇到较强的还原剂时,被还原为Fe2+或者Fe。它们之间能相互转变,其关系常称为铁三角关系。铁的不同价态之间的三角关系,反映出了铁单质及其铁的化合物的化学性质,在解题过程中有重要的作用。
(2)试剂相同、滴加顺序不同,现象不同
A、 NaOH和AlCl3
向AlCl3溶液中滴加NaOH溶液:先出现白色沉淀后消失。
向NaOH溶液中滴加AlCl3溶液:开始无沉淀后出现白色沉淀。
B、 HCl和NaAlO2
向NaAlO2溶液中盐酸:开始出现白色沉淀后消失。
向盐酸溶液中滴加NaAlO2:开始无现象,后出现白色沉淀。
C、 Na2CO3和盐酸(不稳定多元弱酸盐和强酸)
向Na2CO3溶液中滴加盐酸:开始无现象,后产生气泡。
向盐酸溶液中滴加Na2CO3溶液,立即产生气泡。
D、 AgNO3溶液和氨水
向AgNO3溶液中滴加氨水:先出现白色沉淀后消失。
向氨水中滴加AgNO3溶液:开始无沉淀后出现沉淀。
(3)有关Na2O2跟CO2、H2O反应的计算技巧
推广:Wg通式符合(CO)m(H2)n(m=0,1,2,…;n=0,1,2,…)的物质在氧气中燃烧,将其产物通过足量的Na2O2固体,反应完毕后,固体增重Wg,如果(CO)m(H2)n(m=0,1,2,…;n=0,1,2,…)为气体, 反应完毕后,生成气体的体积为原气体体积的一半.符合通式(CO)m(H2)n(m=0,1,2,…;n=0,1,2,…)熟悉的物质有:CO、H2、CH3OH、HCHO、CH3COOH、HCOOCH3、C6H12O6等。
3、其他常见的金属(如:Fe、Al):了解金属的通性,金属冶炼的一般原理。初步了解金属的回收和资源保护。掌握Fe和Al的化学性质。掌握常见金属的活动顺序。以Fe(Ⅱ)Fe( Ⅲ)的相互转化为例,了解变价金属元素的氧化还原性。了解铝的重要化合物。初步了解合金的概念。
Ⅱ、金属单质的知识网络构建:
(1)金属钠及其化合物:金属钠的物性:银白色、硬度小、比水轻、熔点低、易传热、导电
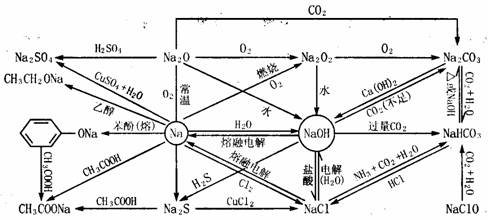
(2)金属镁及其化合物:
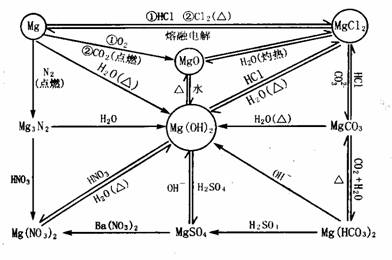
(3)金属铝及其化合物:
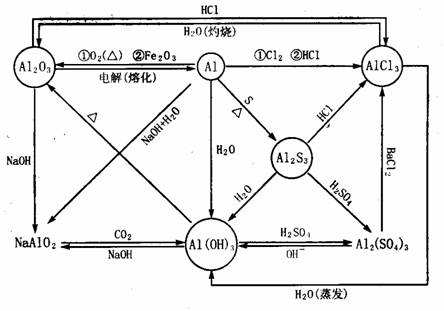
(4)金属铁及其化合物
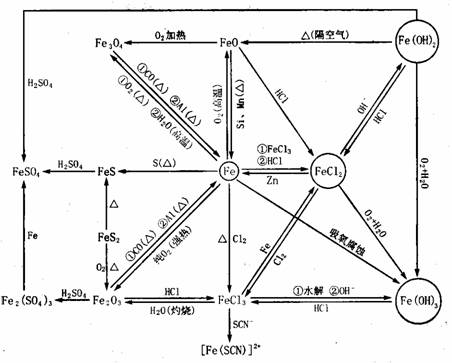
[例题解析]
例1:(2005年上海)含8.0gNaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是 ( )
A.Na2S B.NaHS C.Na2S和NaHS D.NaOH和NaHS
解析:由于不能确定H2S是否过量,因此假设有下列几种情况
若NaOH全生成Na2S时 Na2S的质量为8/40*78*1/2g=7.8g
全生成NaHS时 Na2S的质量为8/40*56g=11.2g而NaOH的质量为8g而得到无水物的质量为7.9g。7.8<7.9<8,7.8<7.9<11.2所以无水物中可能为Na2S和NaOH或Na2S和NaHS,所以无水物中一定有Na2S。
答案:A
点评:本题是一个常规极限法解答题,但仅凭文字计算很容易漏掉一种情况而导致错选,若用图象法和极限法结合解答,则直观明了。数形结合应该是考生处理问题的有效方式。
例题2:某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变成灰绿色,最后变为红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g。另一份加入含0.001molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是____和_____,阴离子是_______.
(2)试通过计算确定该结晶水合物的化学式。
[解析]溶液加Ba(OH)2生成白色沉淀,随即沉淀变为灰绿色,最后变成红褐色,说明水合物中含有Fe2+,逸出能使湿润的红色石蕊试纸变蓝的气体,说明水合物中有NH4+,最后用盐酸处理沉淀,还剩余白色固体说明水合物中有SO42-,再根据计算确定其化学式。
[答案](1)NH4+ Fe2+ SO42-
(2)根据题意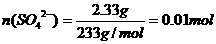
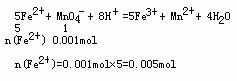
根据离子化合物中阴、阳离子电荷平衡的原理
n(NH4+)+2n(Fe2+)=2n(SO42-)
n(NH4+)=0.01mol
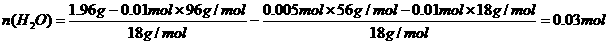 得n(NH4+): n(Fe2+): n(SO42-):n(H2O)=2:1:2:6
得n(NH4+): n(Fe2+): n(SO42-):n(H2O)=2:1:2:6
该结晶水合物的化学式为(NH4)2Fe(SO4)2·6H2O或[(NH4)2SO4·FeSO4·6H2O]
点评:本题为一道常规题,判断化合物组成,写出化学式,关键是在求
NH4+的物质的量时,用到电荷守恒。
[方法归纳]
2、了解金属钠的物理性质,掌握钠和镁化学性质。从原子的核外电子排布,理解ⅠA 、ⅡA族元素(单质、化合物)的相似性和递变性。以氢氧化钠为例,了解重要的碱的性质和用途。了解钠的重要化合物。
1、了解元素原子核外电子排布的周期性与元素性质递变关系。重点掌握典型金属在周期表中的位置及与其性质的关系。了解其他常见金属单质及其化合物。
21、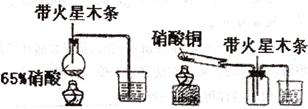 (8分)某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由子实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
(8分)某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由子实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
Ⅰ 装置如下图所示
(1)浓硝酸受热分解的化学方程式是
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确),理由是
Ⅱ 实验装置如上图所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是
(2)当集气瓶中充满红棕色气体时,本条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是
Ⅲ 为了更直按说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。
20、(6分)甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象是: ① 甲与乙或丙混合都产生沉淀;② 丙与乙或了混合也产生沉淀;③ 丁与乙混合产生无色气体。回答下面问题:
(1)写出丁与乙反应的离子方程式:________________________________。
(2)这四种溶液分别是甲:________________、乙:________________、丙:________________、丁:________________。
19、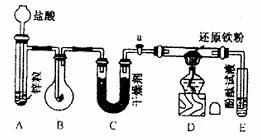 (8分)有实验装置图(见下图)
示意图中A是简易的氢气发生器、B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量浓度适当的盐酸,产生氢气。经必要的“操作”(见问题(2))后,在导管出门处点燃氢气、然后如图所示套上烧瓶B,塞紧瓶赛,气体在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色:
(8分)有实验装置图(见下图)
示意图中A是简易的氢气发生器、B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量浓度适当的盐酸,产生氢气。经必要的“操作”(见问题(2))后,在导管出门处点燃氢气、然后如图所示套上烧瓶B,塞紧瓶赛,气体在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色:
请问答下列问题 (1)实验前如何检查装置的气密性?__________________。 (2)点燃氢气前必须进行__________________操作,进行该操作的方法是____________。 (3)写出B、D分别发生反应的化学方程式。 B中__________________ D中__________________ (4)C中所盛十燥剂的名称是__________________;该干燥剂的作用是______________。
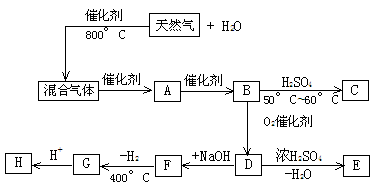
18、(8分)目前世界上有一种动向,即用天然气的主要成分,在催化剂和强热条件下充分作用,制取一种混合气体(成分与水煤气相同),然后用来合成多种有机物。以下是一种合成路线的流程图。其中C是B在少量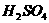 及
及 的条件下生成的三聚物;E是一种能使血红蛋白中毒的气体;F是D的钠盐;G是两分子F脱去一分子氢的缩合产物。
的条件下生成的三聚物;E是一种能使血红蛋白中毒的气体;F是D的钠盐;G是两分子F脱去一分子氢的缩合产物。
回答以下问题:
(1)写出下列物质的化学式:天然气(主要成分)__________;混合气__________,E___________。
结构简式:A ___________,D ___________,F ___________。
(2)写出下列反应的化学方程式:B C ______________________;A与H按物质的量比为2 : 1完全反应:______________________。
C ______________________;A与H按物质的量比为2 : 1完全反应:______________________。
17、(5分)已知:①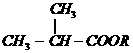

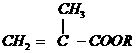
②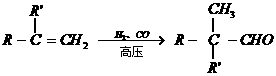
分子量: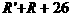 分子量:
分子量: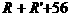
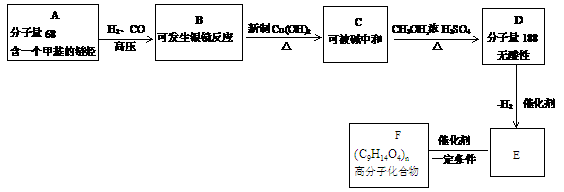 (1)写出化合物A、E、F的结构简式:
(1)写出化合物A、E、F的结构简式:
A_________________;E_________________;F_________________。
(2)写出B与足量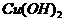 悬浊液反应的化学方程式:_________________。
悬浊液反应的化学方程式:_________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com