
题目列表(包括答案和解析)
7、(1)CO32-+H+=HCO3-
(2)HCO3-+H+=H2O+CO2↑
(3)
课后训练:
|
|
|
|

 A.2NaCl(熔融) 2Na + Cl2↑ B.MgO + H2 Mg + H2O
A.2NaCl(熔融) 2Na + Cl2↑ B.MgO + H2 Mg + H2O

 C.Fe3O4 +
4CO
3Fe + 4CO2 D.2HgO 2Hg + O2↑
C.Fe3O4 +
4CO
3Fe + 4CO2 D.2HgO 2Hg + O2↑
6、(1)3Fe+4H2O(g)
(2)黑色固体变红,右端管壁有水珠
(3)取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色
(4)① 将Fe2+氧化成Fe3+;② 加热浓缩。冷却结晶,过滤
1、AB 2、C 3、C 4、D 5、A
7、 下图表示往某Na2CO3溶液中滴入稀盐酸产生CO2的过程。
下图表示往某Na2CO3溶液中滴入稀盐酸产生CO2的过程。
(1)写出a点以前发生反应的离子方程式
(2)写出a点到b点发生反应的离子方程式
(3)若某Na2CO3溶液中含m molNa2CO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2:1,则滴入稀盐酸的物质的量等于 mol(用m表示)
课堂训练答案:
6、(18分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
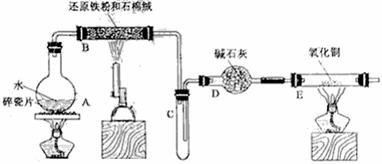
(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液→FeCl3溶液→FeCl3·6H2O晶体
① 步骤I中通入Cl2的作用是 。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
。
③ 该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
。
5、(04上海)等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
(A).3:4:1 (B).3:3:2 (C).6:7:3 (D).6:9:0
4、(03广东)下列有关纯铁的描述正确的是
(A). 熔点比生铁的低
(B). 与相同浓度的盐酸反应生成氢气的速率比生铁的快
(C). 在潮湿空气中比生铁容易被腐蚀
(D). 在冷的浓硫酸中可钝化
3、(2004·上海·16)将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A、稀硝酸 B、稀盐酸 C、硝酸铜 D、氢氧化钠
2、(04广东·)把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀;此时铝元素的主要存在形式是( )
A、Al3+ B、Al(OH)3 C、AlO2- D、Al3+和Al(OH)3
1、(2004年广东)下列有关碱金属铷(Rb)的叙述中,正确的是( )
A、灼烧氯化铷,火焰有特殊颜色
B、硝酸铷是离子化合物,易溶于水
C、在钠、钾、铷三种单质中,铷的熔点较高
D、氢氧化铷是弱碱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com