
题目列表(包括答案和解析)
8、(1)Na2O (2)2Na2O2+2H2O==4NaOH+O2↑
(3)负极, Cl2+2e-==2Cl- (4)Cu+H2O2+2H+==Cu2++2H2O
7、(1)100 : 84(或25 : 21) (2)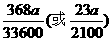 (3)
(3)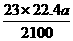
(4)盐酸的物质的量浓度(其他合理答案也给分)
(5)
6、(1)3.00mol/L(1分) (2)67.2g(1分)
(3)(4分)
剩余固体的组成 m的取值范围 n的取值范围
只有铜 0<m≤67.20 0<n≤76.8
有铁且有铜 m>67.2 m-67.2<n≤m+9.6
(4)2.50 mol/L(2分)
8、(2005年,北京) X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是。
(2)Z2Y2与X2Y反应的化学方程式是。
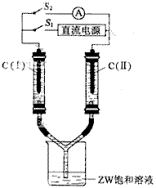
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是(填写正极或负极);
C(II)的电极反应式是。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是。
课后训练答案:1、B 2、A 3、B 4、BC 5、C
7、(05年汕头试卷)现有由等质量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCI的物质的量为 mol。
(3)如果盐酸过量,生成CO2的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道 。
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2
的体积[V(CO2)]范围是 。
6、(2005年丰台检测)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。
现将一块敷有铜箔的绝缘板浸入8.00×102mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol/L AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算:
(1)溶液A中FeCl3的物质的量浓度为__________;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于__________;
(3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表
|
剩余固体的组成 |
m的取值范围 |
n的取值范围 |
|
只有铜 |
|
|
|
有铁且有铜 |
|
(用含m的代数式表示) |
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为_______mol/L。
5、(2005年广东模拟)下列各组溶液中 ,仅用物质间相互反应不能一一区别的一组是
A. Fe2(SO4)3、K2CO3、KHSO4、NH4Cl
B. NaOH、Na2CO3、Al2(SO4)3、MgCl2
C. AgNO3、NaCl、KCl、CuCl2
D. BaCl2、Na2SO4、(NH4)2SO4、KOH
4、(2005年广州测试)下列对铍及其化合物的叙述,不正确的是
A、氯化铍分子中有2对共用电子对
B、铍原子半径小于硼原子半径
C、单质铍能跟冷水反应放出氢气
D、氢氧化铍能跟氢氧化钠溶液发生反应
D、溶液中的c(Na+)减小,有O2放出
3、(2005年广州测试)在一定温度下,向饱和烧碱溶液中放入少量过氧化钠,反应后恢复到原来的温度,下列说法正确的是
A、溶液的pH增大,有O2放出
B、溶液的pH不变,有O2放出
C、溶液中的c(Na+)增大,有O2放出
2、(2004年江苏).向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是( )
A.碳酸氢钠溶液中滴加稀盐酸
B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液
D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com