
题目列表(包括答案和解析)
3. 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高 D.1mo1N4气体转变为N2将吸收882kJ热量
2.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02mg/L,下列措施中能够减少SO2排放量的是 ①用天然气代替煤炭做民用燃料 ②使用水煤气或干馏煤气做燃料 ③硫酸厂使用V2O5作催化剂,加快SO2的转化速率 ④将块状煤粉碎,提高其燃烧效率 ⑤在煤中加入石灰后燃用 ⑥循环处理吸收塔放出的尾气
A.①②③④⑤ B.①③⑤⑥ C.①②⑤⑥ D.②③④⑥
1.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的积不变 ⑤c(H+)一定增大
A ① B ①③ C ①②④ D ①⑤
|
(1)该盐酸的物质的量浓度为多少?(列式计算)
(2)取40gMnO2与该盐酸在加热条件下反应,欲制得标准状况下的氯气8.96L,取该盐酸的体积至少为 mL。
(3)用所得氯气制取漂白粉,求漂白粉的质量。
28.(9分)生活中,人们越来越注意微量元素的摄入,碘元素对人体健康与发育有着至关重要的作用。若缺少碘元素,则会造成幼儿痴呆、发育不良,易患地方性甲状腺肿。为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40mg~50mg的碘酸钾。据此回答下列问题:
 (1)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定的电流强度和温度下电解KI溶液。总反应化学方程式为
(1)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定的电流强度和温度下电解KI溶液。总反应化学方程式为
KI+3H2O KIO3+3H2↑。阳极反应式为
。
(2)为检验某食盐中是否含有碘酸钾。某同学取食盐样品428g溶解后,加入盐酸酸化的淀粉碘化钾溶液,溶液呈蓝色。反应的离子方程式为
该反应中氧化产物与还原产物的物质的量之比为 。
(3)为进一步验证该样品是否为合格产品,该生再用0.030mol/L的硫代硫酸钠溶液对上述溶液进行滴定,当用去18.00mL时蓝色刚好又褪去(I2+2S2O32-====S4O62-+2I-),计算得每千克该加碘盐中碘酸钾的含量为 ,该加碘食盐为
(填“合格”或“不合格”)食盐。
26、(10分)已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
I |
e |
|
原子核数 |
单核 |
四核 |
双核 |
|
粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①-⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
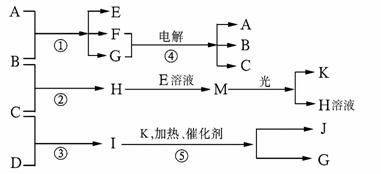
请填写下列空白:
(1)写出下列物质的化学式:B: ;J:_________。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
。
25.(10分)有CH4和CO的混合气体0.5mol在足量O2中充分燃烧,完全反应后将生成物用足量碱石灰吸收,碱石灰增重31g,若用足量Na2O2吸收,Na2O2增重15g.
(1)写出燃烧后的产物与Na2O2反应的化学方程式.
(2)原混合气体V(CH4)=________L,V(CO)=_______L(标准状况下),混合气体的平均相对分子质量为:M=_________
24.(11分)有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
2C(g),△H<0。
(1)若将4molA和2molB在2L的容器中混合,经2s后测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_______________;
(2)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足n(A)+n(B)=n(C),则A的转化率为_________________;
(3)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有____________________________。
23、(13分)某校研究性学习小组选择使用下列仪器和药品,验证由铜和适量浓硝酸反应产生的气体中含有NO(实验中使用的N2和O2的用量可自由控制)。已知:
①NO + NO2 + 2OH- = 2NO2- + H2O;②气体液化温度:NO2:21℃、NO:-152℃
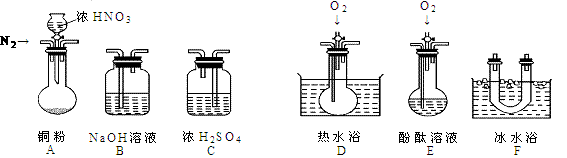
(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”)
甲:________; 乙:________; 丙:_________
具体说明不能验证的主要原因(能验证的方案,不必回答原因):
甲方案:_________________________________________________。
乙方案:_________________________________________________。
丙方案:_________________________________________________。
(2)实验开始时首先通入足量的N2,其目的是:__________________________。
(3)确认气体中含NO的现象是:________________________________ 。
(4)如果O2过量,则装置B中发生反应的离子方程式是:____________________________。
22.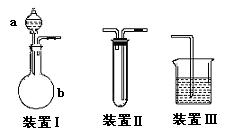 (12分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能。
(12分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能。
(1)甲同学认为利用装置Ⅱ可直接收集NH3、H2,但不能收集O2,其理由是:____________ 。
 (2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改进方法是:_________________________,制O2时在装置Ⅰ中的a中加入________________,b仪器中加入__________________。
(2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改进方法是:_________________________,制O2时在装置Ⅰ中的a中加入________________,b仪器中加入__________________。
(3)丙同学认为装置Ⅱ经乙同学改进后只需在装置Ⅱ之后连一尾气吸收装置即可收集SO2气体。试将吸收SO2的尾气吸收装置画在方框内。
(4)丁同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置Ⅰ中的a仪器中加入_______________试
剂,b仪器中加入________ 试剂,装置Ⅲ中应加入_______试剂,根据装置Ⅲ中观察到的______________________________________________实验现象即可得出Cl2的氧化性比Br2强的结论。
21.(6分)下列有关实验的叙述,正确的是(填序号) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H) 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com