
题目列表(包括答案和解析)
5、某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中溶液的pH=8-9时,检验沉淀是否完全的方法是__________________________
________________________________________________________________________。
在步骤2中,判断沉淀洗涤是否干净的方法是
⑷步骤2中溶液的pH较难控制,可改用________________________________。
4、(12分)苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛。

试回答下列问题:
⑴Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是____________________________。
⑵甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是__________________________________________。
⑶实验过程中,可循环使用的物质分别为_______、_______。
⑷实验中分离甲苯和苯甲醛采用的操作Ⅰ是________,其原理是________________________
____________________________。
⑸实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。
|
反应时间/h |
1 |
2 |
3 |
4 |
5 |
|
苯甲醛产率/% |
76.0 |
87.5 |
83.6 |
72.5 |
64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因_________________
____________________________。
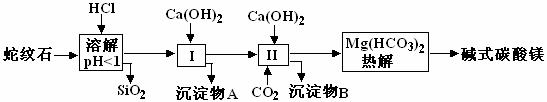
3、蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见右表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是__________________
(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③____________________________________
④____________________________________ ⑤MgO称量
(6)18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________ b =_________ C =_________
2、四川有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):

请填写下列空白:
(1)已知0.5mol甲烷与0.5mol水蒸汽在t℃、pkPa时,完全反应生成一氧化碳和氢气(合成气),吸收了akJ热量,该反应的热化学方程式是: 。
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气。请运用化学反应速率和化学平衡的观点说明采取该措施的理由:
(3)当甲烷合成氨气的转化率为75%时,5.60×107L甲烷为原料能够合成 L氨气。(假设体积在标准状况下测定)
(4)已知尿素的结构简式为H2N-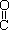 -NH2,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①
;② 。
-NH2,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①
;② 。
1、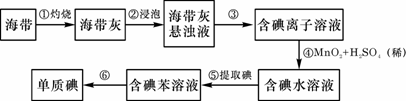 海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是
。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
28.(16分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
 |
 |
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
|
|
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
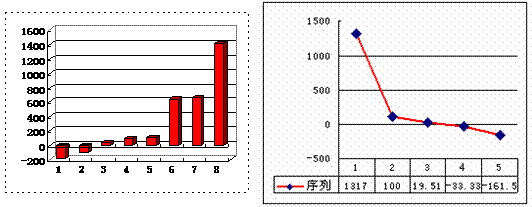
(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 。(填化学式)
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,序列“2”的氢化物的结构式为 。
(5)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该
燃料电池的______极发生电极反应,电极反应式为 。
27.(14分)某化学兴趣小组的同学,在学习了高中化学第三册中有关草酸的性质,查阅了大量资料,获得了草酸的一些信息,整理出下表:
|
(1) 草酸晶体 |
分子式 |
H2C2O4·2H2O |
颜色 |
无色晶体 |
|
熔点 |
100.1℃ |
受热至100.1℃时失去结晶水,成为无水草酸。 |
||
|
(2) 无水草酸 |
结构简式 |
HOOC-COOH |
溶解性 |
能溶于水或乙醇 |
|
特性 |
大约在157℃升华(175℃以上发生分解)。 |
|||
|
化学性质 |
H2C2O4 + Ba(OH)2 =BaC2O4↓+ 2H2O |
|||
|
HOOC-COOH >175℃ CO2↑+CO↑+H2O↑ |
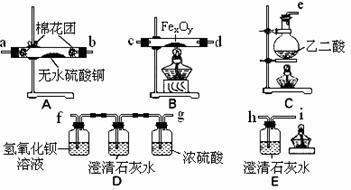 该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。
该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。
请回答下列问题:
(1)实验所需的仪器装置如上图所示,各装置的连接顺序为:
e接 、 接 、 接 、 接 h 。
(2)该组同学进行了下列实验操作:
① 点燃B处的酒精灯;
② 检查实验装置的气密性并装入药品;
③ 反应结束后,先熄灭B处的酒精灯,继续通入气体直到B中固体全部冷却后,再熄灭c处的酒精灯;
④ 点燃c处的酒精灯,开始反应,在装置E的i口处收集一试管气体,验纯;
⑤ 点燃尖嘴i处的酒精灯。
正确的实验操作顺序是: 。
(3)收集气体验纯的目的是 。
D装置中澄清石灰水的作用是 。
E装置中澄清石灰水的作用是 。
(4)反应完全后,该组同学进行数据处理。反应前,称得硬质玻璃管的质量为54.00 g,样品FexOy的质量为7.84 g;反应后,称得硬质玻璃管与剩余固体的总质量为59.60g(其质量经同样操作后也不再发生变化),则样品FexOy中,x:y= 。
(5)本实验有没有不妥之处?如果有,请答出改进的方案;若无,此问可不必答。
。
26.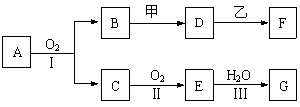 (14分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(14分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅱ在 中进行(填设备名称),工业上反应Ⅲ用于吸收E的试剂是 。
②D的水溶液呈 性(填“酸”、“碱”或“中”)。
③反应Ⅰ的化学方程式是______________________________________________。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是 。
②写出B和甲反应的化学方程式是______________________________________。
③若17 g A与O2反应生成气态的B和C时放出226.7 kJ热量,写出该反应的热化学方程式:___________________________________________________。
25.(16分)某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下:
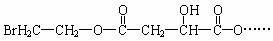
已知:X在足量的氢氧化钠水溶液中加热,可以得到A、B、C三种有机物。
(1)C中只有一种位置的氢原子。
(2)室温下A经盐酸酸化可以得到苹果酸E,E的结构简式为
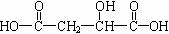 ,
,
试回答:
(1)B中所含官能团的名称是 。
(2)C的结构简式为 。
(3)E不能发生的反应类型是 (填序号)。
①加成反应 ②消去反应 ③氧化反应 ④酯化反应
(4)E的一种同分异构体F有如下特点:1molF可以和3mol金属钠发生反应,放出33.6LH2(标准状况下),1molF可以和足量NaHCO3溶液反应,生成1molCO2,1molF还可以发生银镜反应,生成2molAg。则F的结构简式可能是(只写一种)
。
(5)在一定条件下两分子E可以生成六元环酯,写出此反应的化学方程式:
。
12.将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。用数轴表示的下列化学知识中,正确的是
A.常温条件下,酚酞的变色范围: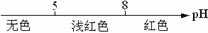
B.分散系的分类:
C.AlCl3和NaOH溶液反应后铝元素的存在形式:
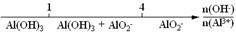
D.CO2与NaOH溶液反应的产物: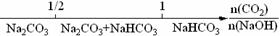
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com