
题目列表(包括答案和解析)
15、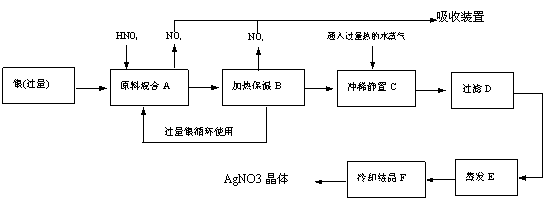 某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下
某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀)。原因是 (填序号,下同)
(a)减少过程中产生NOX的量 (b)减少原料银的消耗量 (c)节省硝酸物质的量
(2)步骤B加热保温的作用是 .
(a)有利于加快反应速率 (b)有利于未反应的硝酸挥发 (c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是
(a)置换反应 (b)水解反应 (c)氧化还原反应
产生的沉淀物化学式 .
流程题答案
14、 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)
。
13、要同时测定混有少量KCl杂质的明矾KAl(SO4)2·nH2O的纯度和结晶水的含量,按下列流程进行实验:
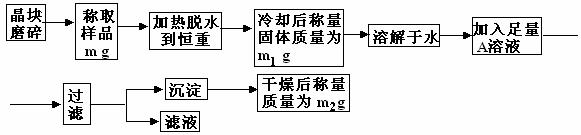 (1)晶块磨碎时使用的仪器名称 ,加热脱水时使用的容器名称 ,若加热过程中有固体飞溅出来造成损失,则会使测得结晶水的含量偏 。
(1)晶块磨碎时使用的仪器名称 ,加热脱水时使用的容器名称 ,若加热过程中有固体飞溅出来造成损失,则会使测得结晶水的含量偏 。
(2)在加热结束后和称量质量之前的这段时间里,需要进行的实验操作是
(3)实验步骤中加入的A溶液应是 溶液。
(4)若加入A溶液的量不足,则会使测得的纯度偏 ,判断A溶液是否足量的方法是
(5)过滤时,玻璃棒的作用是 ,把滤纸上的沉淀洗涤干净,洗涤沉淀物的方法是
(6)通过实验,测得明矾化学式中n值为12,则明矾的纯度为 %。
12、1892年比利时人索尔维以NaC]、C02、NH3、H20为原判制得了纯净的Na2C03,该法又称氨碱法,其主要生产流程如F:
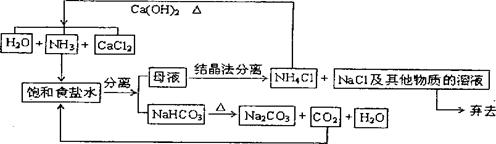
(1)从理论上看循环生产是否需要再补充NH3? 。
(2)从绿色化学原料的充分利用的角度看,该方法有二个明显的缺陷是:
a :b 。
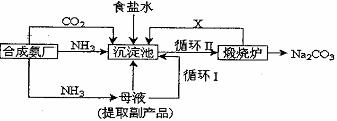 我国化学家侯德榜改革国外的纯碱生产工艺,创造了侯德榜制碱法又叫联碱法,生产流程可简要表示如下:
我国化学家侯德榜改革国外的纯碱生产工艺,创造了侯德榜制碱法又叫联碱法,生产流程可简要表示如下:
(1)上述生产纯碱的方法称,副产品的一种用途为 。
(2)沉淀池中发生的化学反应方程式是 。
(3)写出上述流程中X物质的分子式 。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
该法与氨碱法不同之处有二点:
(3)① 。
②
(4)从理论上看,每再生产lmol Na2C03,再补充的物质及其物质的量分别是 。
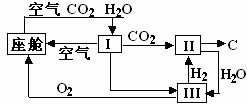
10、航天飞行器座舱内空气更新过程如图所示:
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式
(2)从装置Ⅰ,Ⅱ,Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol O2,呼出
23 mol CO2,则宇航员每天呼出的气体中含H2O mol。
(3)以下是另一种将CO2转化为O2的实验设想

其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
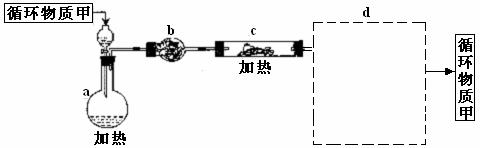
①上图中,装置a由 、 、双孔塞和导管组成
②循环物质甲的名称是
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是
④装置b中填充的物质可能是 (填入编号)
c.硅胶 f.碱石灰 g. 无水氯化钙 h.浓硫酸
⑤设计d装置要注意防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出)。
9、钛被誉为“太空金属”、“未来钢铁”,原因是它的强度大,密度小,抗腐性能好。
(1)室温下,它不与水、稀盐酸、稀H2SO4、稀HNO3作用,但易溶于氢氟酸,推测其原因是 :
A.氢氟酸的酸性比其它酸强 B. 钛离子易与氟离子形成可溶性难电离物质
C.氢氟酸的还原性比其它酸强 D. 氢氟酸的氧化性比其它酸强
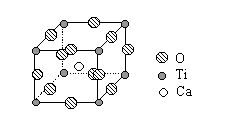 (2)钛的一种超导化合物--钙钛矿晶体中最小重复单元(晶胞)的结构如右图。请回答:
(2)钛的一种超导化合物--钙钛矿晶体中最小重复单元(晶胞)的结构如右图。请回答:
①该化合物的化学式为 ;
②在该化合物晶体中,与每个钛原子距离最近且相等的
其它钛原子共有 个。
(3)由钛铁矿(其主要成分中各原子个数比与(2)中的
化合物一样)提取钛的工艺流程表示如下(部分反应条件略去):

① 方框中所缺物质的化学式为 ;
② 上述5个反应中属于氧化还原反应的是 (填序号);写出其中一个的化学反应方程式: ;
③ TiCl4常温下为无色液体(熔点- 23.2℃,沸点136.4℃),在潮湿的空气中很容易形成烟雾,写出相应的
化学反应方程式: ;
TiCl4是_______化合物(填写:“离子”或“共价”)。
8、钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
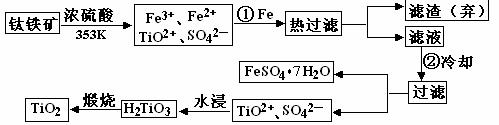
⑴ Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
⑵ 步骤①加铁的目的是____________________________________________________;
步骤②冷却的目的是____________________________________________________
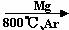 ⑶
上述制备TiO2的过程中,可以利用的副产物是___________;考虑成本和废物综合利用因素,废液中应加入_________________处理。
⑶
上述制备TiO2的过程中,可以利用的副产物是___________;考虑成本和废物综合利用因素,废液中应加入_________________处理。
⑷ 由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2 → TiCl4 Ti
已知:① C(s) + O2(g) == CO2(g); △H = -393.5 KJ/mol
② 2CO(g) + O2(g) == 2CO2(g); △H = -566 KJ/mol
③ TiO2(s) + 2Cl2(g) == TiCl4(s) + O2(g); △H = +141 KJ/mol
则TiO2(s) + 2Cl2(g) + 2C(s)== TiCl4(s) + 2CO(g) 的△H = _________________。
反应TiCl4 + 2Mg == 2MgCl2 + Ti 在Ar气氛中进行的理由是__________________________。
7、聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe3+。实验步骤如下:
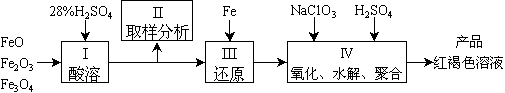
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+ 、Fe3+ 的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+ 含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下:6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+NO↑+4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3+ 物质的量之比不是3︰2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定和的质量(填写化合物的化学式) 。
(6)选出测定过程中所需的基本操作(按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e) 烘干或灼烧
6、氧化铜有多种用途,如作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
⑴制备氧化铜
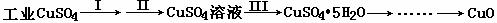
①步骤Ⅰ的目的是除不溶性杂质,操作是:____________________________________。
②步骤Ⅱ的目的是除铁,操作是:滴加H2O2溶液,稍加热;当Fe2+完全转化后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制pH =3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH =1。控制溶液pH =3.5的原因是:______ _______________。
③步骤Ⅲ的目的是得到CuSO4·5H2O固体,操作是:____________、过滤、水浴加热烘干。水浴加热的特点是:___________ _________________________________。
⑵探究氧化铜的性质
①取A、B两支试管,往A中加入适量的CuO粉末,再分别向A和B加入等体积3% H2O2溶液,只观察到A中有大量气泡,结论是:______________ _____________________。
②为探究试管A中的反应速率,收集气体并测定其体积必需的实验仪器有:___ _。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com