
题目列表(包括答案和解析)
23.纤维素是自然界最为丰富的可再生天然高分子资源。
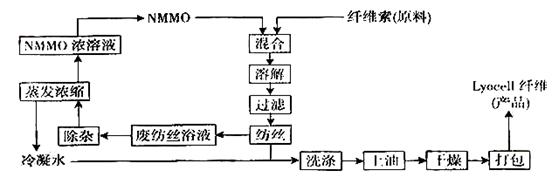
⑴纤维素可制备用于造纸、纺织等的胶粘纤维[成分是(C6H10O5) n],生产过程涉及多个化学反应。工艺简图如下:

近来,化学家开发了一种使用NMMO加工纤维素的新方法,产品“Lyacell纤维”成份也是(C6H10O5) n。工艺流程示意图如下:
① “Lyacell纤维”工艺流程中,可充分循环利用的物质是:_________________________。
② 与“Lyacell纤维”工艺相比,粘胶纤维工艺会产生含有______(只填非金属元素符号)的废物。并由此增加了生产成本。
③“Lyacell纤维”被誉为“21世纪的绿色纤维”,原因是:_________________________。
⑵“Lyacell纤维”工艺流程中的NMMO按以下合成路线制备(反应条件均省略):

其中,化合物Ⅰ可三聚为最简单的芳香烃,化合物Ⅱ可使溴水褪色。
① 化合物Ⅰ也可聚合为在一定条件下能导电的高分子化合物,该高分子化合物的化学式为:_________________________。
② 化合物Ⅱ与O2反应的原子利用率达100%,其化学方程式为:_________。
③ 关于化合物Ⅲ、Ⅳ的说法正确的是:_________(填代号)
A.都可发生酯化反应 B.Ⅲ可被氧化,Ⅳ不可被氧化
C.都溶于水 D.Ⅲ可与钠反应,Ⅳ不可与钠反应
E.Ⅲ是乙醇的同系物 F.Ⅲ可由卤代烃的取代反应制备
④ 写出合成NMMO最后一步反应的化学方程式:
22、(15分)有机物A为茉莉香型香料。
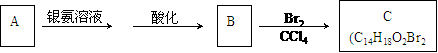
(1)A分子中含氧官能团的的名称是 。
(2)C的分子结构可表示为(其中R和Rノ的代表不同的烃基)

A的化学式是 ,A可以发生的反应是 (填写序号字母)。
a.还原反应 b.消去反应 c.酯化反应 d.水解反应
(3)已知含有烃基R的有机物R-OH与浓溴水反应产生白色沉淀,则含烃基R′的有机物
R′-OH为类别属于 。
(4)A分子结构中只有一个甲基,A的结构简式是 。
(5)在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2的化学方程式是
。
(6)在A的多种同分异构体中,分子结构中除烃基R′含有三个甲基外,其余部分均与A相同的有 种。
21.(8分) 元素周期表是20世纪科学技术发展的重要理论依据之一。2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。按元素周期系的已知规律,该元素应位于第 周期。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在元素周期表中的位置应该是 ;“元素” NH4的单质常温常压下应为 (填“高”或“低”)熔点 (填“固”、“液”或“气”)体, (填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水,“元素” NH4与氯元素形成的化合物为 (填“离子化合物”或“共价化合物”)。
20.(10分)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%
的NaOH溶液,需要称取 gNaOH固体。
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化
膜,取出用水冲洗。写出除去氧化膜的离子方程式 。
(3)如图,组装好仪器,接通开关K,通电约
25min。在阳极生成氧化铝,阴极产生气体。写出
 该过程中的电极反应式:
该过程中的电极反应式:
阳极
阴极
(4)断开电路,取出铝片,用1%稀氨水中和表面
的酸液,再用水冲洗干净。写出该过程发生反应的
离子方程式
19.Ⅰ某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体。
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有 、 。
②制得Al2(SO4)3与K2SO4物质的量之比小于 。
Ⅱ.为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计了下列4种实验装置,请回答下列问题:
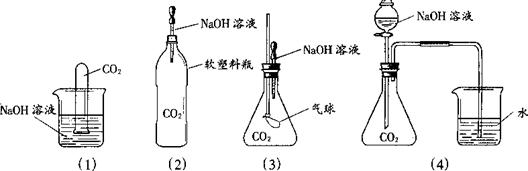
(1)选择实验装置(3),简述出现的实验现象以及产生该实验现象的原因:_________________ __________________________________________________ 。
⑵某同学质疑上述所有实验设计,该同学质疑的依据是_________________________________________________________________________。
⑶在原实验的基础(4)上,请你设计实验证明CO2和NaOH肯定发生了化学反应。
18.(1)
(2)
17. __________
__________
18.(12分)在实验室中拟用氧化铜、稀硫酸、和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案。
甲:(1)CuO溶于适量稀硫酸中;
(2)在(1)的溶液中加入适量锌,反应一段时间后,过滤、烘干,即得纯净的铜。
乙:(1)锌与稀硫酸反应得氢气;
(2)利用中学化学中教材H2和CuO的反应装置,将氢气通入氧化铜中并加热,充分反应一段时间后即得纯净的铜。问:
①若要制得相同质量的纯铜,甲乙所耗用的锌和稀硫酸是否相同?为什么?
②丙同学认为在上述两种方案中,即使充分反应一段时间,所制得的铜仍混有杂质难以保证纯度,应对上述两种方案加以完善。你是否赞同丙同学的看法?为什么?你认为应怎样补充完善甲、乙两个实验方案?
17.(6分)下列有关实验的叙述,正确的是(填序号)(少一个扣一分,多一个倒扣一分,扣完为止) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H) 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
16.将40mL 1.5mol/L的CuSO4溶液与30ml 3mol/L的NaOH溶液混合,生成浅蓝色的沉淀,假如溶液中[Cu2+]或[OH-]都已变得很小,可忽略,则生成沉淀的组成可表示为
(A) Cu(OH)2 (B)CuSO4•Cu(OH)2
(C)CuSO4•2Cu(OH)2 (D)CuSO4•3Cu(OH)2
第Ⅱ卷 非选择题(共86分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com