
题目列表(包括答案和解析)
11.把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为
A.C(CH3COO-)>C(Na+) B.C(CH3COOH)>C(CH3COO-)
C.2C(H+)=C(CH3COO-)-C(CH3COOH) D.C(CH3COOH)+C(CH3COO-)=0.01mol·L-1
12.蒽与苯炔反应生成化合物X:
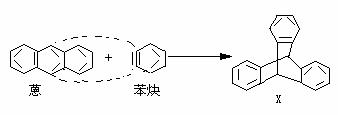
X中一个氢原子被甲基取代的所有异构体数为
A.2种 B.3种 C.4种 D.5种
13.在一恒定容积的容器中充入2mol的A和1mol的B发生反应:2A(g)+B(g)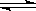 XC(g)。达到化学平衡后,C的体积分数为a。若在恒温恒容下,按0.6mol的A、0.3mol的B、1.4 mol的C为起始物质,达到化学平衡后,C的体积分数仍为a,则X的值可能为
XC(g)。达到化学平衡后,C的体积分数为a。若在恒温恒容下,按0.6mol的A、0.3mol的B、1.4 mol的C为起始物质,达到化学平衡后,C的体积分数仍为a,则X的值可能为
A.2 B.3 C.4 D.无法确定
14. 下列反应的离子方程式正确的是
A.硫酸亚铁在空气中氧化: 4Fe2++3O2+6H2O=4Fe(OH)3
B.向Ba(OH)2溶液中加入少量NH4HSO4溶液:
|
C.用石墨电极电解CuSO4溶液:Cu2++4OH-====2Cu+O2↑+2H2O
D.用澄清石灰水吸收过量二氧化碳气体: OH-+CO2=HCO3-
9、可以用来判断醋酸属于弱电解质的实验事实是
A.醋酸属于共价化合物
B.醋酸钠溶液呈碱性
C.相同条件下,醋酸溶液的导电性较盐酸溶液的导电性弱
D.醋酸能与水以任意比混溶
10、设N0为阿伏加德罗常数的值,下列说法不正确的是:
A、 16g甲烷中含有的电子数为10N0
B、 标准状况下,22.4升三氧化硫中含有的原子数为3N0
C、46g二氧化氮和46g四氧化二氮含有的原子数均为3N0
D、常温常压下,22.4升的D2、H2组成的气体中分子数小于N0
8、1
mol有机物  与足量NaOH 溶液充分反应,消耗NaOH 物质的量为
与足量NaOH 溶液充分反应,消耗NaOH 物质的量为
A.5 mol B.4 mol C.3 mol D.2 mol
7、相同条件下,等体积的pH=2的醋酸与盐酸,将其稀释m倍和n倍,使之变为pH=3,则m和n的关系为:
A、m>n B、m<n C、m=n D、无法确定
5、强酸与强碱在稀溶液里反应的反应热可表示为:
H+(aq)+OH-(aq)=H2O(l); △H=-57.3 kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ;△H=-Q1 kJ·mol-1
HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ;△H=-Q2kJ·mol-1
上述均系在溶液中进行的反应,Q1、Q2的关系正确的是
A.Q1=Q2=57.3 B.Q1>Q2>57.3 C.Q1<Q2=57.3 D.无法确定
6、对于反应 4NH3(g)+5O2(g)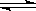 4NO(g)+6H2O(g) (正反应为放热反应),下列有关叙述正确的是
4NO(g)+6H2O(g) (正反应为放热反应),下列有关叙述正确的是
A.若降低温度,达到新的化学平衡时,NO的体积分数将增大
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.对NH3与O2的反应来说,化学反应速率关系是2υ(NH3)=3υ(H2O)
4、短周期元素X和Y,X元素位于Y的前一周期,其原子最外电子层只有一个电子Y原子的次外层电子数是最外层电子数的1/3,则X和Y形成的化合物的化学式可表示为
A.X2Y3 B.X3Y C.XY2 D.X2Y
3、下列物质长时间存放在敞口瓶里,发生变质的是
①硅酸钠水溶液;②亚硫酸钠溶液 ③五氧化二磷 ;④硫酸亚铁
A.③ B.①②④ C.②③④ D.①②③④
2、2003年2月1日,美国哥伦比亚号航天飞机在返回地面的途中坠毁,举世震惊。尽管科学家在探索太空的过程中遇到了挫折,但这决不会阻止人类对太空科学研究的步伐。该航天飞机用铝粉和高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4=N2↑ +4H2O+Cl2↑+2O2↑-ΔH
下列对此反应的叙述中错误的是:
A、 上述反应瞬间产生大量高温气体推动飞机飞行;
B、 在反应中高氯酸铵只起氧化剂作用;
C、 反应从能量变化上说,主要是化学能转变为热能和动能;
D、 上述反应中反应物的总能量大于生成物的总能量。
1、学生经常使用的涂改液中含有挥发性的有毒溶剂,应尽量不要使用,以减少对身体的危害及对环境的污染,该溶剂是
A.乙醇 B.乙酸 C.三氯乙烯 D.甘油
24、Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L硝酸恰好使混合物溶解,同时收到224mLNO气体(标准状况下)。
(1)Cu2O与稀硝酸反应的化学方程式为
__________________________________________________
(2)产物中硝酸铜的物质的量为____________。
(3)如混合物中含0.01mol Cu,则其中Cu2O和CuO的物质的量各为多少?
25硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO3+NaNO2+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
①计算吸收液中NaNO2和NaNO3物质的量之比。
②1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
高三化学第二次月考
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com