
题目列表(包括答案和解析)
4.右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.H2S B.HCl
C.PH3 D.SiH4
3.下列实验或叙述不符合绿色化学理念的是
 A.制CuSO4时先将Cu氧化成CuO后再与稀H2SO4反应
A.制CuSO4时先将Cu氧化成CuO后再与稀H2SO4反应
B.采用银作催化剂,乙烯和氧气制取环氧乙烷,原子利用率100%
C.用乙醇代替汽油作汽车燃料
D.用稀HNO3和铜制取Cu(NO3)2
2.下列过程中属于化学变化的是
① 白色的硫酸铜粉末久置于空气中变成蓝色;②同素异形体之间的互变;③福尔马林用来浸制标本;④同分异构体之间的互变;⑤蜂蚁螫咬处涂稀氨水或小苏打溶液可以减轻痛苦;⑥氯化钠溶液通电后导电
A.只有①②④⑤ B.只有①④⑤ C.只有①②③④⑤ D.全部
1.2006年诺贝尔化学奖授予美国科学家Roger.D.Kormberg,他揭示了真核生物体内的细胞如何利用基因内存储的信息生产蛋白质。下列关于蛋白质的说法中正确的是
A.蛋白质均为天然有机高分子化合物,没有蛋白质就没有生命
B.蛋白质均易溶于水,均能跟浓硝酸作用变黄
C.可以采用多次盐析或多次渗析的方法分离提纯蛋白质
D.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
26、(8分)3.2g Cu与过量硝酸(a mol·L-1,30mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol。
(2)求生成的气体中NO2和NO的物质的量(用含有a的式子表示)。
(3)用NaOH溶液吸收产生的气体,原理为:2NO2+2NaOH==NaNO3+NaNO2+H2O,
NO2+NO+2NaOH==2NaNO2+H2O。若生成的混合气体能被NaOH完全吸收,试讨论a的取值范围。
25、(8分)减弱“温室效应”的有效措施之一是大量的植树造林,绿色植物在叶绿素存在下的光合作用是完成二氧化碳循环的重要一环。已知叶绿素的相对分子质量小于900,其分子中含C:73.8%(以下均为质量分数),H:8.3%, N:6.3%, O:8.9%,其余为Mg.
(1)求Mg元素的质量分数。
(2)试确定叶绿素的化学式.
24、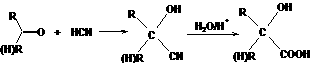 (8分) 已知:
(8分) 已知:
有机玻璃可按下列路线合成:
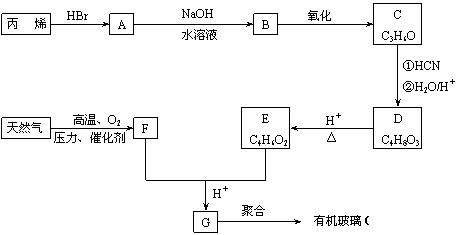
|
|
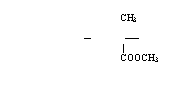
F亦可由水煤气在高温、高压、催化剂存在下合成,C不能发生银镜反应。试写出:
(1)天然气的主要成分和C的结构简式分别为 、 ;
(2)E+F→G的反应方程式为 ;
(3)丙烯→A和A→B的反应类型分别属于 、 ;
(4)D→E的反应方程式为 。
六(本题包括2小题,共16分)
18.足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为
A.1︰2 B.3︰2 C.3︰1 D.6︰1
第Ⅱ卷(非选择题,共78分)
三(本题包括2小题,共26分)
19.(12分)为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用浓硫酸与无水乙醇共热至170℃,将生成的气体通入溴水,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,乙醇与浓硫酸反应的混合液变黑,推测在制得的乙烯中还可能含有还原性的杂质气体,由此他提出必须先除之,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要反应的化学方程式:
(2)甲同学设计的实验 (填能或不能)验证乙烯与溴水发生加成反应,理由是 (填字母)
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙烯
d.使溴水褪色的物质,就是乙烯
(3)乙同学推测该气体中一定含有的杂质气体是 ,它能与溴水反应,验证过程中必须先除去。
 (4)请选用下列装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框并写出装置内所放药品:
(4)请选用下列装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框并写出装置内所放药品:
(浓硫酸、乙醇) ( ) ( ) ( 溴水 )
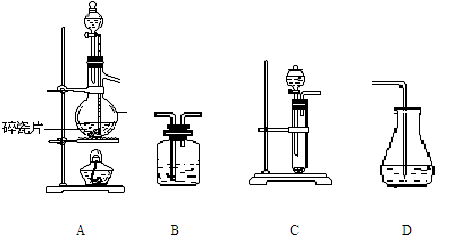
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是 。
20、(14分)SO2是大气污染物之一,为粗略测定周围环境中SO2的含量,某课外活动小组设计了如下实验装置:

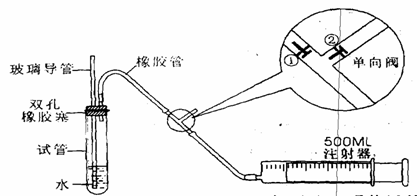
注:单向阀原理说明:当注射器推活塞时,①关闭,②打开;
当注射器拉活塞时,①打开,②关闭。
(1)甲、乙两同学欲对上述整套装置检查气密性:
甲同学是用手捂住试管(或微热试管),观察导管中是否有液面上升的现象。是否能? (填能或不能);
乙同学是由先玻璃导管向试管中注入水,观察导管中液面与试管中液面是否形成高度差,且在一段时间后,观察液面差是否变化的方法。是否能? (填能或不能);
若上述两种方案均不能,请思考新方案,并填下列空白(若上述可行,则不填下列空白):
先在试管中装入适量水(保证玻璃导管的下端浸没在水中),然后(填操作方法) ,看到 (填实验现象),证明该装置的气密性良好。
(2)向试管中加入0.0005mol·L-1的碘水1.0mL,用适量的蒸馏水稀释后,再加入2-3滴淀粉溶液,配置成溶液A。测定指定地点空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由 色变为 时反应恰好完全进行,此时停止抽气,该反应的离子方程式为 。
(3)我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值(mg·m-3):
一级标准:0.15 二级标准:0.50 三级标准:0.70。该课外活动小组分成第一活动小组和第二活动小组,使用相同的实验装置和溶液A,在同一地点、同时测量空气中SO2的含量。当反应恰好完全进行,记录抽气时间和次数如下(假定每次抽气500mL)。请将下表填写完整(计算时保留2位有效数字):
|
分组 |
第一小组 |
第二小组 |
|
抽气时间 |
20分钟 |
21分钟 |
|
抽气次数 |
100 |
130 |
|
SO2含量:mg·m-3 |
|
|
①在实验过程中,需缓缓抽动活塞的目的是 ;
若快速抽拉,则测定的结果将 (填偏大、偏小或无影响);
②判断该地点的空气中SO2含量属于 (填数字)级标准, (“第一”或“第二”)小组的测定结果正确,另一小组实验结果产生较大偏差的原因是(两个小组所用药品和装置均无问题)
。 。
四(本题包括2小题,共20分)
21、(8分) 据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月才充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。
(1)该电池反应的总离子方程式为 ;
(2)甲醇在 极发生反应(填正或负),电池在放电过程中溶液的pH将 (填下降或上升、不变);若有16克甲醇蒸汽被完全氧化产生电能,并利用该过程中释放的电能电解足量的CuSO4溶液,(假设能量利用率为80%),则将产生标准状况下的O2 升。
(3)最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆) 固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。①电池的正极反应式为 ;
②放电时固体电解质里的O2-离子的移动方向是向 极移动(填正或负)。
22、(12分)气体A中只X、Y两种短周期元素,X的原子序数大于Y的原子叙述。B、D、E是中学化学中的常见气体。固体乙是一种复杂的化合物,是具有磁性的黑色晶体;F是目前用途最广、用量最大的金属单质,F与C在高温下发生反应生成E和固体乙。各物质有如下图所示的转化关系。
试回答下列问题:
(1)若气体A中,X与Y质量比小于3,则气体A中肯定有(写化学式) ,
若X与Y质量比为5:2,则气体A的摩尔质量为 。
(2)为验证A气体的组成,可采取的方法为 。(填字母)
A、上网 B、查资料 C、实验
(3)若已知标准状况下A气体的体积以及完全燃烧后B和C的质量,能否确定A的组成? (填字母)A、能 B、不能 C、因具体数值而定。
(4)写出下列反应的方程式:
①高温下,F与C反应的化学方程式 ;
②足量的F与X稀硝酸反应的离子方程式 。
五(本题包括2小题,共16分)
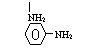
|
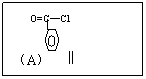

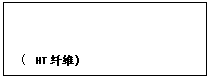 23、(本题8分)(1)用间苯二甲酰氯(A)与间苯二胺(B)经缩聚反应可制得HT纤维,写出HT纤维的结构简式:
23、(本题8分)(1)用间苯二甲酰氯(A)与间苯二胺(B)经缩聚反应可制得HT纤维,写出HT纤维的结构简式:

|
|
 (2)阿司匹林问世已有100多年,是驰名的治感冒、头痛、发烧、风湿和缓解、治疗其他疼痛的畅销药物。英国药学家约翰·文博士及其同事们由于发现其作用机理而获得1982年诺贝尔奖。现代医学证明,它在防治心脑血管疾病方面,特别是抑制手术后血栓、心肌梗塞和抑制血小板凝聚有效,成为医学界常用药物。
(2)阿司匹林问世已有100多年,是驰名的治感冒、头痛、发烧、风湿和缓解、治疗其他疼痛的畅销药物。英国药学家约翰·文博士及其同事们由于发现其作用机理而获得1982年诺贝尔奖。现代医学证明,它在防治心脑血管疾病方面,特别是抑制手术后血栓、心肌梗塞和抑制血小板凝聚有效,成为医学界常用药物。
|
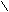
 ①写出用水杨酸(
)与乙酸酐( CH3-C
)合成
①写出用水杨酸(
)与乙酸酐( CH3-C
)合成
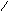
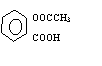

 阿司匹林(
)的化学方程式。
阿司匹林(
)的化学方程式。
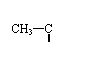
|
②已知A、B二种芳香族化合物均为阿司匹林的同分异构体,写出其结构简式。
A、水解后得到一种二元酸和一种醇 ;
B、水解后得到一种二元酚和两种酸 。
17、下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象相同的是:
A、NaHSO4、Ba(OH)2 B、NaAlO2、H2SO4
C、AlCl3、NaOH D、AgNO3、NH3·H2O
15.乙烯在硫酸催化作用下的水化合成乙醇经过下列步骤;首先在较低温度下乙烯被浓H2SO4吸收:
CH2=CH2十H2SO4(浓)→CH3CH2OSO3H (I)
然后生成物(I)再进一步吸收乙烯,产生生成物(II):
CH3CH2OSO3H + CH2=CH2→( CH3CH2O)2SO2 (II)
加水时,生成物(I)和(II)都与水反应生成乙醇:
CH3CH2OSO3H +H2O→CH3CH2OH+H2SO4
(CH3CH2O)2SO2 + 2H2O→2CH3CH2OH+H2SO4
下列叙述中正确的是:
(1)化合物I、II都属于酯类;
(2)上述生成I、II化合物的反应都属于酯化反应(酸和醇起作用生成酯和水的反应叫做酯化反应);
(3)上述生成I、II化合物的反应都属于加成反应;
(4)上述生成醇的反应都属于取代反应
A.只有(1) B.只有(1)(3) C.只有(1)(3)(4) D.(1)(2)(3)(4)
16.24mL0.05mol·L-1的Na2SO3恰好与20mL0.02mol·L-1的K2R2O7溶液完全反应,则R元素在还原产物中的化合价为
A.0 B.+2 C.+3 D.+6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com