
题目列表(包括答案和解析)
24.(6分)在碘量瓶(一种专用锥形瓶)中加入5.00mL的NaClO漂白液(密度为1.00g·mL-1),再加入过量的KI溶液。然后,加入适量稀H2SO4,立即以淀粉溶液为指示剂,用0.100mol·L-1Na2S2O3溶液滴定,到达终点时消耗Na2S2O3溶液33.8mL。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
(1)写出NaClO与KI反应的离子方程式: 。
(2)计算漂白液中NaClO的质量分数w(NaClO)。
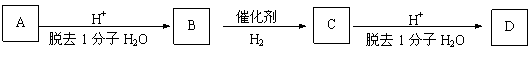
23. (10分) 生产工程塑料PBT(
)的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。
(10分) 生产工程塑料PBT(
)的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。
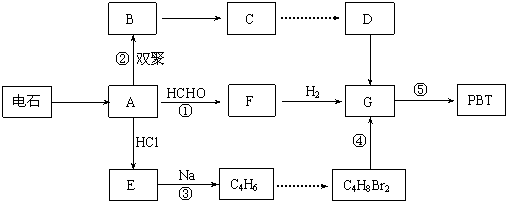
请你结合下列所给有关信息,回答问题。
Ⅰ.CH2=CH-CH=CH2与Br2的CCl4溶液发生1∶1加成可得到BrCH2-CH=CH-CH2Br和BrCH2-CHBr-CH=CH2二种产物。
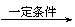
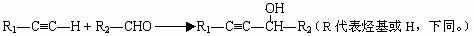 Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅲ.
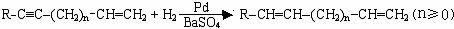 Ⅳ.
Ⅳ.
⑴写出E和F的结构简式: 、 。
⑵写出反应⑤的化学反应方程式: 。
⑶请你设计出由B→C…→D的反应流程图(有机物用结构简式表示,必须注明反应条件)。
 提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:

 B C
…… G
B C
…… G
22.(8分)某二元醇A,含氧的质量分数为27.1%,其余是碳和氢。A有如下图转化关系,在转化的过程中碳原子连接方式可能发生变化,A、B、C、D分子结构中都有4个甲基,且均为链状结构。(已知有机物中同一碳上连接两个羟基不稳定)
回答下列问题:
(1)A的相对分子质量是: 。
(2)A和D的结构简式分别是 和 。
(3)B转化为C的化学方程式是(有机物用结构简式表示):
。
21.(10分)碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
(1)在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
|
时间 |
起始 |
14min后 |
30min后 |
75min后 |
|
pH |
<2.0 |
=2.5 |
<3.5 |
=3.5 |
试解释排气管中放出气体的pH变化的原因_____________________________________如果把排气管加长一倍,排气的pH_________(回答“增大”“减小”或“不变化”),解释原因_______________________________________________________________
(2)上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这种物质是__________________,为什么此时会有沉淀析出__________________________________________________
20.(10分)A的组成中含有六个结晶水,A、B均溶于水,G是一种重要化工原料。A、 B按下图转化关系(图中忽略了一些物质):
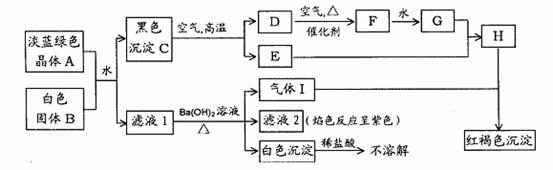
回答下列问题:
(1)写出化学式,A:__________________;B:___________________。
(2)写出C→D+E反应的化学方程式:________________________________。
(3)写出下列反应的离子方程式,
气体I和H的溶液反应:_____________________________________;
D和H的溶液反应:__________________________________________。
19.(8分)下表是元素周期表中第一、第二周期10种元素的某种性质的一组数据(数据单位相同)。除带“……”的四种元素除外,其余元素都给出了该种元素的全部数据。
|
(H) 13.6 |
|
|
|
|
|
|
(He) 24.6 54.4 |
|
(Li) 5.4 75.6 122.5 |
(Be) 9.3 18.2 153.9 217.7 |
(B) 8.3 25.2 37.9 259.4 340.2 |
(C) 11.3 24.4 47.9 64.5 392.1 489.9 |
(N) 14.5 29.6 47.4 72.5 97.9 552.1 …… |
(O) 13.6 35.1 …… …… …… …… …… |
(F) 17.4 34.9 …… …… …… …… …… |
(Ne) 21.6 41.6 …… …… …… …… …… |
⑴每组数据可能是该元素的 。
A.原子得到电子所放出的能量 B.单质在不同条件下的熔、沸点
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径大小
⑵稀有气体元素的第一个数据较大的原因是__________________________________;请你推测镁和铝的第一个数据的大小Mg_____Al。
⑶同一元素原子的一组数据中,有的数据增大特别多,形成突跃,这些数据出现的规律,说明原子结构中 。
18.(12分)
纯碱是一种重要的化工原料,某课外活动小组拟在实验室中测量Na2CO3试样的纯度。甲组利用图1中给出的仪器设计了图2所示的装置,用来测定Na2CO3试样的纯度(杂质不与酸溶液反应),其中A容器中盛有Na2CO3样品10.0g,分液漏斗内盛有稀硫酸(足量),B容器内为碱石灰固体(足量)。他们利用碱石灰的增重求出纯净的Na2CO3质量,再求纯度。(设原容器中CO2气体的含量可忽略不计,各容器内反应完全,下同)。
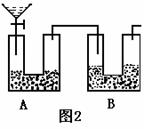
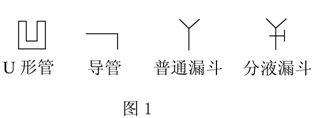
乙组同学通过仔细分析,认为甲组的装置简单,但误差较大,在甲组装置的基础上,设计了一套实验装置(见图3),请你认真分析这套实验装置,并回答有关问题:(实验室中可供选择的试剂和药品还有锌片、浓硫酸、稀硫酸、NaOH溶液,CaCO3固体,蒸馏水)

(1)乙组同学设计的装置是否完整?如不完整,请在B、D虚框内画出合适的装置简图,如要用到药品或试剂,请将药品或试剂的名称写在横线上 。
(2)A装置中分液漏斗所盛液体为 ;U形管内盛有 ;A装置在整套装置中的作用 ; F装置的作用是 。
(3)如果B、D内部不设计任何装置而直接连通ACE,则实验结果将 (偏高、偏低、无影响)。
(4)乙组称取Na2CO3试样10.0g,如果实验后E装置质量增重3.96g,则该Na2CO3试样的纯度为 。
17.(10分)为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。
⑴图一可通过观察 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。
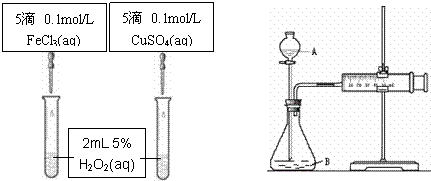
图一 图二
⑵检查图二装置气密性的方法是
图二所示实验中需测量的数据是 。
16.下列溶液中有关微粒的物质的量浓度关系正确的是
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③NH4HSO4三种溶液中c(NH4+):①<②<③
D.相同条件下,pH=5的 ①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③
第二卷(非选择题 共86分)
15.我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池,常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为
LaNi5H6+6NiO(OH) LaNi5+6Ni(OH)2 下列说法正确的是
LaNi5+6Ni(OH)2 下列说法正确的是
A.放电时储氢合金作正极
B.放电时负极反应:LaNi5H6+6OH--6e- = LaNi5+6H2O
C.充电时阳极周围c(OH-)增大 D.充电时储氢合金作负极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com