
题目列表(包括答案和解析)
9.下列离子方程式书写正确的是
A.Ba(OH)2溶液和(NH4)2SO4溶液混合:Ba2++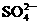 =BaSO4↓
=BaSO4↓
B.碳酸氢钙溶液与少量的石灰水反应: Ca2++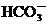 +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O

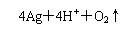
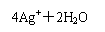
C.用直流电电解AgNO3溶液:
D.Na2O2粉末加入水中:2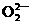 +2H2O=4OH-+O2↑
+2H2O=4OH-+O2↑
8.从下列事实所得出的相应结论正确的是
|
|
实验事实 |
结论 |
|
A |
常温下白磷可自燃,而氮气要在放电条件下才与氧气反应 |
非金属性:P>N |
|
B |
CO2的水溶液可导电 |
CO2是电解质 |
|
C |
SO2通入硝酸钡溶液出现白色沉淀 |
沉淀为硫酸钡 |
|
D |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
同浓度pH:NaAlO2 < NaHCO3 |
7.下列各项因果关系中正确的是
A.金刚石的熔点高于晶体硅,因为两种晶体中原子间平均距离前者小于后者
B.水的热稳定性比较高,因为水分子之间存在氢键
C.金属晶体能导电,因为金属晶体中存在金属阳离子
D.离子晶体硬度较大、难于压缩,因为离子晶体中的阴、阳离子排列很有规则
6. 关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
C.氨易液化与氨分子间存在氢键无关
D.H2O是一种非常稳定的化合物,这是由于氢键所致
5.下列各种情况下一定不能大量共存的离子组是
A.能与Al反应放出H2的溶液中:Na+、K+、CO32-、SO42-
B. PH为11的溶液:S2-、SO32-、 S2O32-、Na+
C.能与Na2CO3反应放出CO2的溶液中:H+、Mg2+、Ba2+、I-
D.pH为1的紫色溶液中:K+、Fe2+、Cl-、MnO4-
4.设NA为阿伏加德罗常数,下列有关说法正确的是
A.标准状况下,22.4LSO3中含有的氧原子数为3NA
B.铜的电解精炼时,当阴极析出32gCu时,阳极产生的Cu2+离子数为0.5NA
C.将5.0mol·L-1的FeCl3溶液20mL滴加到沸水中形成的胶体中,分散质粒子数为0.1NA
D.常温常压下,14 g乙烯中含有的共用电子对数为3NA
3.下列物质有固定的熔点,且熔点逐渐降低的一组物质是
A.HI、HBr、HCl、HF B.石英、食盐、干冰、钾
C.重油、柴油、煤油、汽油 D.KI、I2、Hg、O2
2.下列实验操作中,所使用的有关仪器要求干燥的是
A.中和滴定实验中所用的锥形瓶 B.喷泉实验中收集氯化氢气体的圆底烧瓶
C.配制一定物质的量浓度溶液时所用的容量瓶 D.制取CO时用于收集CO的集气瓶
1. 开发和和平利用核能是人类解决能源危机的一个重要途径。原子核在一定条件下发生裂变(fission)或聚变(fusion)能释放出大量的能量,这就是核能。下面是一个自发进行的核裂变过程:
开发和和平利用核能是人类解决能源危机的一个重要途径。原子核在一定条件下发生裂变(fission)或聚变(fusion)能释放出大量的能量,这就是核能。下面是一个自发进行的核裂变过程:
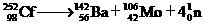 。下列有关说法正确的是
。下列有关说法正确的是
A.核裂变或聚变中化学能转变为核能 B.该核裂变遵循能量守恒定律
C.Ba是人工核反应制得的超铀元素
D.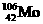 中含有106个中子
中含有106个中子
25.(12分)工业生产粗硅的主要原理为:SiO2 + 2C 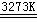 Si(粗)
+2CO↑
Si(粗)
+2CO↑
⑴若在制粗硅的过程中同时生成了碳化硅,且二者物质的量之比为1∶1,则参加反应的C和SiO2的质量比为 。
⑵工业上可通过以下原理由粗硅进一步制纯硅:
Si(粗)
+ 2Cl2(g) 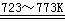 SiCl4(l) SiCl4 + 2H2
SiCl4(l) SiCl4 + 2H2
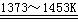 Si(纯)
+ 4HCl
Si(纯)
+ 4HCl
若上述反应中Si(粗) 和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂多少吨?
⑶工业上还可以通过如下图所示的流程制取纯硅:
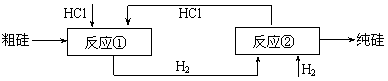
反应①:Si(粗)
+ 3HCl(g) 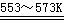 SiHCl3(l) + H2(g)
SiHCl3(l) + H2(g)
反应②:SiHCl3 + H2 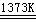 Si(纯)
+ 3HCl
Si(纯)
+ 3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①HCl中的利用率为75%,反应②中和H2的利用率为80%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com