
题目列表(包括答案和解析)
19.(15分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将
CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
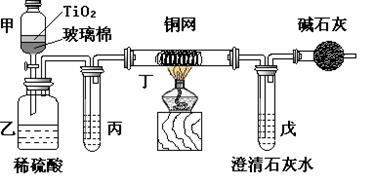
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)
倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
⑴ 甲中反应的离子方程式为 ,
乙中反应的离子方程式为 。
⑵ 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是 ,
丁在实验中的作用是 ,
装有碱石灰的干燥管的作用是 。
⑶ 戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因。① 。
② 。
请提出一个能提高准确度的建议(要有可操作性,且操作简单)
。
18.(11分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶 于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,
写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
17.(8分)下图为中学常用定量仪器的部分结构(有的仪器被放大),回答下列问题:
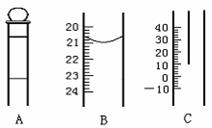
⑴ 中和热测定实验中应用到上述仪器中的 (填序号),该仪器在中和热测定实验中放置的位置是 ;
⑵ 配制一定物质的量浓度溶液的实验中应用到上述仪器中的 (填序号),如果读数时视线偏高,则所得溶液的物质的量浓度将 (填“偏大”“偏小”或“不变”);
⑶ 测定某待测浓度时,一般用 手操作B仪器。
16.2.8gFe全部溶于一定浓度、100mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是
A.反应前HNO3溶液的浓度为2.0mol·L-1 B.1.12L的气体全部为NO
C.反应后溶液中c(NO3-)=1.6mol·L-1 D.反应后的溶液最多还能溶解1.61gFe
第Ⅱ卷(非选择题,共86分)
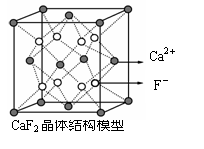
15.下列关于晶体的说法正确的是
A.离子晶体中一定不含共价键
B.金属晶体的熔点一定比原子晶体低、一定比分子晶体高
C.CaF2晶体中与一个Ca2+距离最近且距离相等F-的有4个
D.SiO2晶体中每个Si原子与四个O原子以单键相结合
14.X、Y、Z、W均为短周期元素且核电荷数依次增加,X的最外层电子数是内层电子总数的3倍,Y原子最外层只有一个电子,Z与X的核电荷数之比为3∶2,W原子的最外层电子数比次外层电子总数少1。有关下列叙述正确的是
A.最高价氧化物对应的水化物的碱性:YOH>Z(OH)2
B.氢化物的沸点:HW>H2X
C.X、Y两元素形成的离子化合物中阴、阳离子个数比一定为1∶2
D.X、W两元素形成的化合物中X通常为正价
13.有机物A和B均由C、H、O三种元素中的两种或三种组成,关于A、B两种物质的燃烧,其中正确的是
A.质量相等的A、B燃烧生成等质量的H2O,则可推知A、B具有相同的最简式
B.物质的量相等的A、B燃烧生成等质量的H2O、CO2,则A、B必然互为同分异构体
C.物质的量、质量均相等的A、B燃烧生成等质量的H2O、CO2,则A、B必然互为同分异构体
D.物质的量相等的A、B燃烧耗氧量、生成的CO2均相等,则两者分子组成相差若干个“H2O”
12.莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,在0.1mol/L的该盐的溶液中,下列有关比较不正确的是
A.c (SO42-) > c (NH4+)>c (Fe2+)>c (H+)>c (OH-)
B.c(NH3· H2O)+c (NH4+) = 0.2mol/L
C.2c (SO42-)+ c (OH-) = c (NH4+) + 2c (Fe2+)+ c (H+)
D.c(H+) = c(OH-) + c(NH3· H2O)
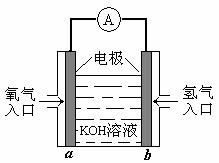
11.下图为一种氢氧燃料电池的示意图。关于该氢氧燃料电池的说法中正确的是
A.a电极上发生的电极反应式为O2+4H++4e-=2H2O
B.b电极上发生的电极反应为还原反应
C.外电路中电子从b电极流向a电极
D.电池工作时电池内部的电解质溶液pH不变
10.一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol·L-1。下列有关判断不正确的是
A.反应达平衡时N2的转化率为7.5%
B.反应进行到10s末时,H2的平均反应速率是0.0225mol·(L·s)-1
C.该反应达到平衡时的标志是容器中气体密度不再改变
 D.该反应达到平衡时的标志是容器中气体压强不再改变
D.该反应达到平衡时的标志是容器中气体压强不再改变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com