
题目列表(包括答案和解析)
9.在25℃时,将两个惰性电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,阴极上逸出amol气体,同时有wg Na2SO4·10 H2O晶体析出,若温度不变,则剩余溶液中溶质的质量分数为( )
A.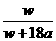 ×100%
B.
×100%
B. ×100%
×100%
C. 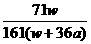 ×100%
D.
×100%
D.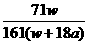 ×100%
×100%
8.用惰性电极电解100mL浓度为0.05mol/L的CuSO4溶液,通电一段时间,Cu2+恰好反应完全,若溶液体积仍为100mL,此时溶液的pH为( )
A.1 B.2 C.12 D.13
7.下列离子反应方程式正确的是( )
A.铜和硫酸锌溶液:Cu+Zn2+====Cu2++Zn
B.澄清的石灰水中加入少量NaHCO3溶液:Ca2++2OH-+2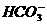 ====
CaCO3↓+2H2O+
====
CaCO3↓+2H2O+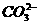
C.少量的盐酸逐滴滴入碳酸钠溶液: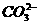 +2H+==== CO2↑+H2O
+2H+==== CO2↑+H2O
D.溴化亚铁溶液中通入少量氯气:2 Fe2++ Cl2====2 Fe3++2Cl-
6.最近我国某近代物理研究所取得重大科研成果,研制出首批氧-18气体(18O2),氧-18是一种稳定的氧的同位素,称为重氧。下列有关说法正确的是( )
A.1.8g氧-18气体(18O2)的物质的量是0.1mol
B.0.1mol重氧水H218O所含的中子数为6.02×1023
C.0.2mol氧-18气体(18O2)的体积约为4.48L
D.氧-18气体的摩尔质量是36g
5.根据磷元素的原子结构示意图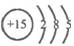 ,作出如下推理,其中与事实不符的是( )
,作出如下推理,其中与事实不符的是( )
A.磷元素位于元素周期表的第三周期、第VA族
B.磷原子不如氮原子和硫原子的得电子能力强
C.磷单质不如氮气和硫单质活泼
D.磷的氢化物(PH3)受热时不如氮的氢化物(NH3)和硫的氢化物(H2S)稳定
4.下列各物质中,所有原子都满足最外层为8电子结构的是( )
A.Be Cl2 B.PCl3 C.PCl5 D.NH3
3.FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
A.加入饱和MgSO4溶液都发生聚沉
B.分散质的粒子都不能通过半透膜
C.都比较稳定,密封保存一段时间都不会产生沉淀
D.加入硫酸先产生沉淀,后沉淀溶解
2.从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是( )
A.Na2S B.S C. SO2 D.H2SO4
1.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域做出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是( )
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
9、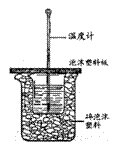 用右图所示装置进行中和热测定实验,请回答下列问题:
(1)大小烧杯之间填满碎泡沫塑料的作用是
,从实验装置上看,图中缺少的一种玻璃仪器是
。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=
,H2SO4与NaOH反应的热化学方程式为
。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。
10、A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素;A、B,C三种元素的原子序数之和为31;D元素与A、B、C三种元素处于不同周期。请填空:
(1)C元素的名称 ,A、D两种元素形成的离子电子式为
。
(2)A、B、C、D四种元素组成的正盐的水溶液显酸性,用离子方程式表示其原因:
(3)BD3与BA2的反应常用于某工业尾气的处理,该反应的化学方程式为
。
(4)D2C和D2A2溶液反应生成了C的单质,该反应的化学方程式为
。
11、在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:2A(g)+B(g)
用右图所示装置进行中和热测定实验,请回答下列问题:
(1)大小烧杯之间填满碎泡沫塑料的作用是
,从实验装置上看,图中缺少的一种玻璃仪器是
。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=
,H2SO4与NaOH反应的热化学方程式为
。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。
10、A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素;A、B,C三种元素的原子序数之和为31;D元素与A、B、C三种元素处于不同周期。请填空:
(1)C元素的名称 ,A、D两种元素形成的离子电子式为
。
(2)A、B、C、D四种元素组成的正盐的水溶液显酸性,用离子方程式表示其原因:
(3)BD3与BA2的反应常用于某工业尾气的处理,该反应的化学方程式为
。
(4)D2C和D2A2溶液反应生成了C的单质,该反应的化学方程式为
。
11、在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:2A(g)+B(g)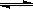 C(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD。
请填写下列空白:
(1)从反应开始至达到平衡,用D表示的平均反应速率为
。
(2)B的平衡浓度为
,A的转化率为
。
(3)在温度不变时,如果缩小容器体积,平衡体系中混合气体的密度
、平均相对分子质量
。(两空均填“增大”、“减少”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则还应加入
mol B物质。
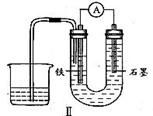
12、用下图I所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。
C(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD。
请填写下列空白:
(1)从反应开始至达到平衡,用D表示的平均反应速率为
。
(2)B的平衡浓度为
,A的转化率为
。
(3)在温度不变时,如果缩小容器体积,平衡体系中混合气体的密度
、平均相对分子质量
。(两空均填“增大”、“减少”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,最初加C和D各2mol,要使平衡时各物质的体积分数与原平衡相等,则还应加入
mol B物质。
12、用下图I所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。
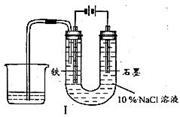
 (1)用装置1电解食盐水时,总反应的离子方程式为
,为什么石墨电极上方得到气体的体积比铁电极上方得到气体的体积小得多?
。如果所用食盐水中含有MgCl2杂质,在电解过程中还可以观察到的现象是 。
(2)用装置Ⅱ进行实验时,有关电极反应式为:铁电极
,石墨电极
。
(1)用装置1电解食盐水时,总反应的离子方程式为
,为什么石墨电极上方得到气体的体积比铁电极上方得到气体的体积小得多?
。如果所用食盐水中含有MgCl2杂质,在电解过程中还可以观察到的现象是 。
(2)用装置Ⅱ进行实验时,有关电极反应式为:铁电极
,石墨电极
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com