
题目列表(包括答案和解析)
4、CCTV“科技博览”报道,2004年3月中科院首创用CO2合成可降解塑料,
 O
O

 聚二氧化碳 [ C-O ]n,下列说法合理的是
聚二氧化碳 [ C-O ]n,下列说法合理的是
A、聚二氧化碳是通过加聚反应制得的
B、聚二氧化碳与干冰互为同素异形体
C、聚二氧化碳与干冰都是纯净物
D、聚二氧化碳的使用会产生白色污染
3、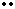
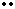
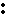
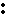
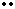
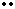 以下电子式错误的是
以下电子式错误的是
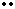
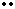

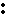

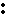
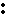
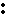
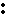
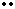
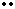
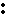
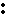
 A、Na+ B、H O
O H C、H+[ Cl
]- D、[
S C N ]-
A、Na+ B、H O
O H C、H+[ Cl
]- D、[
S C N ]-
2、空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A、推广使用燃煤脱硫技术,防治SO2污染
B、实施绿化工程,防治扬尘污染
C、研制开发燃料电池汽车,消除机动车尾气污染
D、加大石油、煤炭的开采速度,增加化石燃料的供应量
1、所有酸和碱中都含有的元素是
A、Na B、Cl C、H D、O
24、某纯净的天然碱可看做二氧化碳和氢氧化钠反应的产物。取6.64g天然碱用酒精灯充分加热至恒重,将生成的气体依次通过过量的浓硫酸、过量澄清石灰水后,浓硫酸增重0.9g,澄清石灰水中生成沉淀1g。
(1)充分加热后,剩余固体重 g;
(2)该天然碱成份中除含有碳酸钠外,还含有 (填化学式);
(3)6.64g天然碱中,含碳酸钠的物质的量为 mol;
(4)该天然碱的化学式为 。
23、(13分)某同学用如图1所示的装置来探究SO2的性质及CO2、SO2与澄清石灰水的反应实验。
(1)实验前应先检验装置的气密性,方法是
。
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出该反应的化学方程式 。
(3)分别将SO2气体通入下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液中,现象是 ,继续通入过量的SO气体,现象是 。
②SO2通入紫红色KMnO4溶液,现象是 ,写出反应的离子方程式 。
③SO2慢慢通入(可以1个个气泡通入)澄清石灰水中,现象 。
④SO2通入少量的澄清石灰水中,没有明显现象,产生此现象的原因是 。
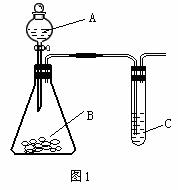
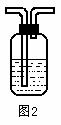
(4)若该同学制取的SO2气体中混有CO2气体,请你设计实验证明混合气体既有SO2气体,又有CO2气体。可以选择下列洗气装置进行设计实验。
洗气装置里的溶液是:A浓硫酸、 B氢氧化钠溶液、 C硫酸铜溶液 、D 品红溶液、E澄清石灰水、 F高锰酸钾溶液、G碳酸氢钠溶液。
上述装置的连接顺序是(用字母表示,所给装置可以重复使用,有些装置也可以不用) 。
22、(9分) 已知
又知A为烃,在一定条件下两个E分子之间缩合可生成六元环状化合物,H为高分子化合物,相关物质转换关系如图:
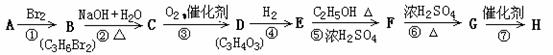
(1)以上反应中,属于取代反应的有 (填序号,下同),属于消去反应的有
(2)写出下列物质的结构简式:D F
(3)写出下列反应的化学方程式:
B→C
G→H
21.(8分)在25mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如右图所示,
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式
。
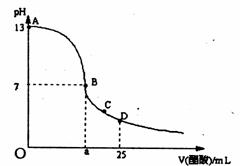 (2)该氢氧化钠溶液的物质的量浓度为
(2)该氢氧化钠溶液的物质的量浓度为
mol·L-1
(3)在B点,a 12.5ml(填“大于”、“小于”或“等于”,下同)。若由体积相等的氢氧化钠和醋酸混合而且恰好呈中性,则混合前c(NaOH)________ c(CH3COOH),混合前酸中 c(H+)和碱中c(OH-)的关系:c(H+)________ c(OH-)。
(4)在D点溶液中离子浓度大小关系为
。
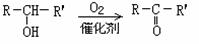
20.(8分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为气体化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。
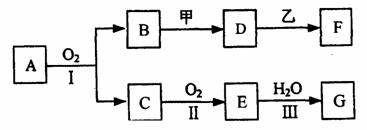
则①A的分子式是 ,甲的电子式是 。
(2)D的溶液与乙反应的离子方程式是 。
(3)若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式: 。
19.(10分)根据表中左栏信息,回答右栏有关问题:
|
信 息 |
问 题 |
|
①短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数。其中X是形成化合物种类最多的元素。 |
(10)X元素的最高价氧化物的电子式是 _______ |
|
②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液。 |
(2)Z元素在元素周期表中位于第_____ 周期,_____族。 |
|
③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成。 |
(3)写出生成白色沉淀的化学方程式_____
__。 |
|
④向上述四种元素的单质的混合物中加入足量的烧碱,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中有白色沉淀。 |
⑷最终生成白色沉淀的离子方程式为_____
__。 |
|
⑸X、Y、Z、W四种元素的原子半径由大到小的顺序为____________(用元素符号表示) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com