
题目列表(包括答案和解析)
14、下列关于电解质溶液的叙述正确的是
A、常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D、常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
13、 以下实验装置一般不用于分离物质的是
A B C D
12、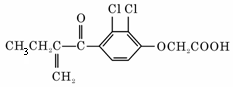 利尿酸在奥运会上被禁用,其结构简式如右图所示。下列叙述正确的是
利尿酸在奥运会上被禁用,其结构简式如右图所示。下列叙述正确的是
A、利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B、利尿酸分子内处于同一平面的原子不超过10个
C、1 mol利尿酸能与7 mol H2发生加成反应
D、利尿酸能与FeCl3溶液发生显色反应
11.在原电池和电解池的电极上所发生的反应,同属还原反应的是
A、原电池的正极和电解池的阳极所发生的反应
B、原电池的正极和电解池的阴极所发生的反应
C、原电池的负极和电解池的阳极所发生的反应
D、原电池的负极和电解池的阴极所发生的反应
10、某物质有以下性质:①是电解质,②溶解时有化学键的破坏,③熔化时没有化学键的破坏。则该物质固态时属于
A、分子晶体 B、原子晶体 C、离子晶体 D、金属晶体
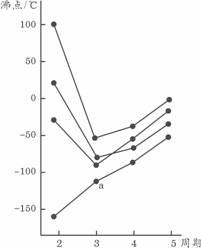
9、右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.H2S B.HCl
C.PH3 D.SiH4
8、 设NA代表阿伏加德罗常数,下列说法正确的是
A、5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B、100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子数均为0.2NA
C、标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D、20 g重水(D2O)中含有的电子数为10NA
7、 下列做法正确的是
A、将浓硝酸保存在无色玻璃瓶中
B、用镊子取出白磷并置于水中切割
C、把氯酸钾制氧气后的残渣倒入垃圾桶
D、氢气还原氧化铜实验先加热再通氢气
6、以下性质的比较中,错误的是
A、熔点:金刚石 > 碳化硅 > 晶体硅
B、溶液的导电性:0.2 mol/L的CH3COOH溶液 > 0.1 mol/L的H2SO4溶液
C、酸性:H3PO4 > H2CO3 > H3BO3
D、离子半径:Cl- > N3- > Na+ > Mg2+
5.我国“神舟六号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均为无色,但在卫星发射现场看到火箭喷射出大量红烟,产生红烟的原因是
A、高温下N2遇空气生成NO2 B、NO遇空气生成NO2
C、CO2与NO反应生成NO2 D、NO与H2O反应生成NO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com