
题目列表(包括答案和解析)
3.将NO3-+Zn+OH-+H2O -- NH3+Zn(OH)42-配平后,离子方程式中H2O的化学计量数为( )
A.3 B.4 C.5 D.6
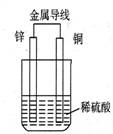 4.对右图所示装置的叙述,正确的是( )
4.对右图所示装置的叙述,正确的是( )
A.Cu是负极,Cu片上有气泡产生 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
2.下列含有非极性键的共价化合物是( )
A.HCl B.Na2O2 C.C2H2 D.CH4
1.下列物质与相应现象不相关的是( )
A.SO2-酸雨 B.NO2-光化学烟雾
C.氟氯烃-臭氧层空洞 D.甲烷-煤气中毒
31、2 g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+ → 10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+ → 5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的 KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)写出KMnO4与(NH4)2Fe(SO4)2溶液反应的离子方程式:
____________________________________________________________________
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中 Cu2S的质量分数为 。
30、氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3 → 2CuCl↓+3Na2SO4+CO2↑
⑴CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。
⑵准确称取0.2500 g CuCl样品,放到足量的0.5 mol/L FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.1000 mol/L的Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关反化学反应为
Fe3++CuCl → Fe2++Cu2++Cl- Ce4++Fe2+ → Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
29、
 复方阿司匹林主要含有阿司匹林、非那西汀和咖啡因三种成分。已知:
复方阿司匹林主要含有阿司匹林、非那西汀和咖啡因三种成分。已知:

 ①
Cl + CH3OH + NaOH →
OCH3 + NaCl + H2O
①
Cl + CH3OH + NaOH →
OCH3 + NaCl + H2O



 ②
NO2 + 3Fe + 6HCl →
NH2 +3FeCl2 + 2H2O
②
NO2 + 3Fe + 6HCl →
NH2 +3FeCl2 + 2H2O


 O O
O
O O
O
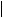
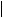 ③ 2CH3-C-O-C-CH3 +
H2N-CH2→CH3-C-NH-CH2 +
2CH3COOH
③ 2CH3-C-O-C-CH3 +
H2N-CH2→CH3-C-NH-CH2 +
2CH3COOH
 (醋酸酐)
H2N-CH2 CH3-C-NH-CH2
(醋酸酐)
H2N-CH2 CH3-C-NH-CH2
O


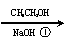 (1)利用如下反应可合成非那西汀(一些反应未注明)
(1)利用如下反应可合成非那西汀(一些反应未注明)
A(Cl- -NO2) B C D(非那西汀)
写出反应类型:①__________________;②____________________;
D的结构简式是_______________________________。
(2)阿司匹林是一种酯,经酸性水解可生成水杨酸和乙酸。若用甲醇和水杨酸发生酯化反应可生成水杨酸甲酯,即另一种镇痛药--冬青油,它的结构简式为:
OH
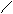
 -COOCH3。则水杨酸的结构简式为________________________;
-COOCH3。则水杨酸的结构简式为________________________;
阿司匹林的结构简式为_______________________________。
(3)阿司匹林有多种同分异构体,请写出其中一种的结构简式,该物质不与金属钠反应,
且苯环上的一氯代物只有两种:__________________________。
28、已知在一定条件下乙炔与醛(或酮)可发生加成反应,生成醇炔。如:

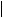
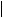 H
H
H
H

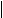

 R-C O + CH CH
R-C-C CH
R-C O + CH CH
R-C-C CH
OH

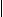
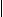 Rˊ
Rˊ
Rˊ
Rˊ

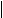

 R-C O +
CH CH
R-C-C CH
R-C O +
CH CH
R-C-C CH
OH
下面是一种工业上以乙炔为原料合成顺丁橡胶的示意图:
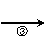
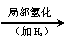
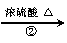

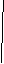

 CH CH
CH CH


 B
C
D [CH2-CH CH-CH2 ]n
B
C
D [CH2-CH CH-CH2 ]n
 A
顺丁橡胶
A
顺丁橡胶
根据以上事实回答如下问题。
(1)写出A → D的结构简式。
A_______________,B_______________,C________________,D_________________。
(2)写出①②③反应的化学方程式并注明反应的类型。
① ________________________________________________________( );
②_________________________________________________________( );
③_________________________________________________________( )。


 (3)要求制取合成橡胶 [ CH2-C CH-CH2 ]n ,除乙炔外,可代换A的化合物的结构
(3)要求制取合成橡胶 [ CH2-C CH-CH2 ]n ,除乙炔外,可代换A的化合物的结构
CH3
简式是 __________________。
27.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
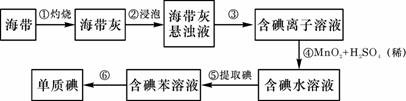
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是
。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
。
26、 工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于 _____ 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 ____________________代替(填写物质名称)。
(4)若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
25、下表是元素周期表的一部分
|
族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
二 |
|
① |
|
② |
③ |
④ |
|
|
三 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
四 |
|
|
|
|
|
|
⑩ |
(1)表中③元素的氢化物的电子式为_______________,此氢化物的水溶液的pH比⑨元素的氢化物的水溶液的pH_________(填“大” 、“小” 或“相等”),上述两种氢化物形成的化合物其水溶液呈__________性(填“酸” 、“碱” 或“中”)
(2) ⑤⑥⑧⑨元素形成的简单离子中离子半径最大的是_____________(填离子符号)
(3) ①元素与⑥元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式______________________________________
(4) ⑦元素与④元素形成的化合物属____________晶体。
(5)在⑨与⑩的单质中,化学性质较活泼的是__________,写出可以验证该结论的一个化学反应方程式__________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com