
题目列表(包括答案和解析)
11.下列实验操作中,行后顺序正确的是 ( )
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,后放入坩埚中
C.为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
D.在实验室制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸
9.下列各组离子一定能大量共存的是 ( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在C(H+)=10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
|
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
8.铊(T1)是某超导材料的组织元素之一,与铝同族,位于第6周期。T13+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+。下列推断正确的是 ( )
A.Tl+的最外层有1个电子 B.Tl3+的氧化性比Al3+弱
C.Tl能形成+3价和+1的化合物 D.Tl+的还原性比Ag强
7. 对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4V正(O2)=5V逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2V正(NH3)=3V正(H2O)
6.下列反应离子方程式正确的是 ( )
A.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=AlO2-+2H2O
B.向苯酚钠溶液中通入二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+CO32-
C.向小苏打溶液中加入醋酸溶液:HCO3-+H+=CO2↑+H2O
D.向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl-
4.叠氮酸(HN3)与醋酸性相似,下列叙述中错误的是 ( )
A.HN3水溶液中微粒浓度大小顺序为 C(HN3)>C(H+)>C(N3-)>C(OH-)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:C(Na+)>C(N3-)>C(OH-)>C(H+)
D.N3-与CO2含相等电子数
|
A.NH4Cl NH3↑+HCl↑ B.NH3+CO3+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O D.Na2O2+2CO2=2Na2CO3+O2
3.关于如图所示装置的叙述,正确的是( )
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
2.NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下22.4L N2含共用电子对数为NA
B.常温常压下1mol H2含共价键个数为NA
C.常温常压下,18.0g重水(D2O)所含的电子数为10NA
D.1mol CH3CH2CH(CH3)2所含甲基个数为2NA
1.Se是人体必需微量元素,下列关于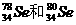 的说法正确的是 ( ) A.
的说法正确的是 ( ) A.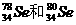 互为同素异形体
互为同素异形体
B.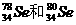 互为同位素
互为同位素
C.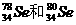 分别含有44和46个质子
分别含有44和46个质子
D.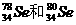 都含有34个中子
都含有34个中子
26.现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100 mL 2.0 mol·L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入140 mL 4.0 mol·L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。
⑴计算这包铝热剂中铝的质量和氧化铁的质量。
⑵计算实验②产生气体的体积(标准状况)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com