
题目列表(包括答案和解析)
5.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关
于C3N4晶体的说法错误的是 ( )
A.该晶体属于原子晶体,其化学键比金刚石更牢固
B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
4.用惰性电极实现下列电解实验,其说法正确的是 ( )
A.电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
3.有M、N、P、E四种元素,从下列实验事实 ( )
(1)M+N2+(水溶液)=M2++N
(2)P+2H2O(冷)=P(OH)2+H2↑
(3)N和E相连放入E的硫酸盐溶液中,电极反应式为:E2++2e→E N-2e→N2+
试判断它们还原性由强到弱的顺序是
A.M、N、P、E B.M、N、E、P C.E、P、M、N D.P、M、N、E
[i].下列变化属于物理变化的是 ( )
A.加热胆矾成白色硫酸铜粉末 B.氢氧化铁胶体加入硫酸镁产生沉淀
C.石墨在高温高压下转变成金刚石 D.碘与淀粉溶液作用呈现蓝色
2.往溴的苯溶液中加入少量铁屑能迅速反应,其过程如下:3Br2+2Fe=2FeBr3;Br2+FeBr3
=FeBr4-+Br+(不稳定); +Br+→[
+Br+→[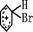 ];[
];[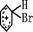 ]+FeBr4-→
]+FeBr4-→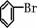 +HBr+FeBr3;由上反
+HBr+FeBr3;由上反
应可知: +Br2→
+Br2→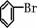 +HBr中的催化剂为 ( )
+HBr中的催化剂为 ( )
A.Fe B.FeBr3 C.Br+ D.FeBr4-
28.(8分)2.80g铁与100mL稀硝酸混合充分的反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL 0.2mol/L的碘化钾溶液,恰好将溶液中的Fe3+全部还原,求原硝酸溶液的物质的量浓度。
27.(6分)某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液a L与pH=1的H2SO4溶液b L混合。设混合溶液体积为两者之和,所得固体体积忽略不计。
(1)若所得混合溶液为中性,则a:b= ,生成沉淀的物质的量为
(最终结果可用a、b表达式表示)
(2)若a:b=9:2,则所得溶液pH= ,该混合溶液最多能溶解铁粉 g。
26.(10分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
⑴装置B中发生反应的化学方程式是
。
⑵装置E中的现象是 。
⑶停止反应,待B管冷却后,取其中的固体,
加入过量稀盐酸充分反应,过滤。简述检验滤液中
Fe3+的操作方法:
。
 (4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液 FeCl3溶液 FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是 。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
。
25.(8分)将等物质的量A、B、C、D四种物质混合,发生如下反应:
aA+bB→cC(s)+dD 当反应进行一定时间后,测得A减少了n mol,B减少了0.5nmol ,C增加了1.5nmol,D增加了n mol,此时达到化学平衡:
⑴该化学方程式中各物质的化学计量数为a= ,b= ,c= ,d= .
⑵若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:
A B D
⑶若升高温度,反应一段时间后,测知四种物质物质的量又达到相等,则该反应为
反应(填“放热”或“吸热”)
24.(6分)取体积相同(0.025L)的两份0.10mol/L NaOH溶液,把其中的一份放在空气中一段时间后,溶液的PH (填“增大”、“减小”或“不变”),其原因是 。用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为VA,另一份消耗硫酸溶液的体积为VB,则:
⑴以甲基橙为指示剂时,VA与VB的关系是 ;
⑵以酚酞为指示剂时,VA与VB的关系是 。
22.(8分)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出XKJ热量。
⑴通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
⑵已知单质磷的燃烧热为y KJ/mol,则1molP与O2反应生成固态P2O3的反应热△H=
。
⑶写出1molP与O2反应生成固态P2O3的热化学方程式: 。
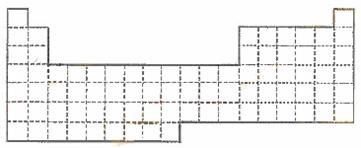 23.
23.
⑴ 在上面元素周期表中画出金属元素与非金属元素的分界线。
⑵ 根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
⑶ 现有甲、乙两种元素,甲元素原子核外M层上有7个电子,乙元素的焰色反应显黄色。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
②甲元素与硫元素相比较,非金属性较强的是 (填名称),
写出可以验证该结论的一个化学反应方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com