
题目列表(包括答案和解析)
26.现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后,全部投入含b mol HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:(已知:2Fe3++Cu==2Fe2++Cu2+)
(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列空白:
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
溶液中 的离子 |
|
Fe2+ |
|
Fe2+
Cu2+ |
|
Fe3+
Cu2+ |
|
残留固 体成分 |
Fe Cu |
|
Cu |
  |
  |
  |
(2)当溶液中金属离子只有Fe2+ 、Cu2时,求b的取值范围。
(3)当x=0.5,溶液中Fe3+ 与Fe2+的物质的量相等时,在标准状况下共产生672mL气体。求a、b的值。
25.有一个烧杯盛放硝酸钾的浓溶液(不饱和),在提供降温的条件下,你如何利用温度计
和固体的溶解度曲线表(表内含硝酸钾溶解度曲线),测定该硝酸钾浓溶液中溶质的质
量分数。请填写测定步骤:
(1)在烧杯中放入温度计,降温,_____________________________________________ 。
(2)将烧杯中的溶液加热,使晶体重新溶解后,____________________________________
______________________________________________________________________。
(3)________________,查硝酸钾溶解度曲线,找出该温度下硝酸钾的溶解度S。
(4)硝酸钾的浓溶液中溶质的质量分数计算式为:________________。
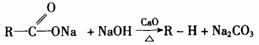
24.下列反应在有机化学中称为脱羧反应:
已知某有机物A的水溶液显酸性,遇 FeCI3不显色,苯环上的基团处于对位位置,且 A分子结构中不存在甲基;I为环状化合物,其环由5个原子组成;J可使溴水褪色;I和J互为同分异构体;K和L都是医用高分子材料。各有机物的相互转化关系如下图:
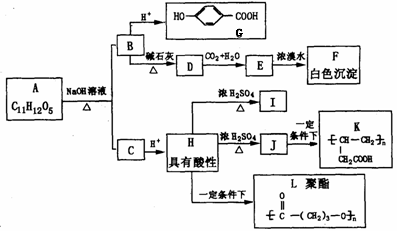

据此请回答下列问题:
(1)写出A的结构简式:___________________ 。
(2)物质G的同分异构体中:
①属于酚类,同时也属于酯类的化合物有_______种,请写出其中一种的结构简式_____________;
②属于酚类,但不属于羧酸类或酯类的化合物的结构简式为___________________(任写一种) ;
(3)写出反应类型:H→L:________________;J→K:________________。
(4)写出有关反应化学方程式(有机物写结构简式):
E→F:________________________________________________;
H→I:________________________________________________。
23.由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1mol B离子与1mol E离子作用可生成2mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
(1)微粒A的电子式是_____________;微粒E的名称是___________________。构成微粒F的元素在元素周期表中的位置是_________________________________。
(2)写出下列反应的离子方程式:
F+过量C溶液:
W+含大量B离子的溶液:
(3)六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓苛性钠溶液,产生的现象有:a.溶液中出现白色沉淀 b.有刺激性气味气体放出 c.沉淀逐渐增多 d.沉淀完全消失 e.沉淀逐渐减少
①该复盐在溶液中的电离方程式是_________________________。
②上述各实验现象由先到后出现的正确顺序是(填写序号)___________________。
22.一定温度下,分别往容积均为5L的甲(恒压容器)、乙(恒容容器)中加入0.5mol无色
的N2O4气体,立即出现红棕色。当反应进行到达2s时,测得乙容器中N2O4的浓度为
 0.09mol/L。经过60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒
0.09mol/L。经过60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒
定)
(1)容器中气体出现红棕色的原因(用化学方程式表示)是 ;
(2)前2s内乙容器中以N2O4的浓度变化表示的反应速率为 ;
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大小”“小于”或“等于”,
以下同);容器内N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
(4)若要使甲、乙中N2O4浓度相等,不能采取的措施是 (填选项的标号)。
A.保持温度不变,适当压缩甲容器体积;
B.保持容器体积不变,使甲容器升温;
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
21.完成下面各小题:
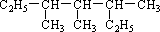 (1)命名:
(1)命名:
(2)如果该烷烃是由炔烃与H2加成得到的,则可能的炔烃有 种。
(3)如果该烷烃是由烯烃与H2加成得到的,写出可能烯烃的结构简式(写3种)。
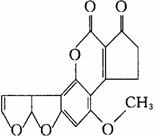
20.黄曲霉素AFTB(右图所示)是污染粮食的真菌霉素,
人类的特殊基因在黄曲霉素作用下会发生突变,有
引发肝癌的可能性,关于黄曲霉素的说法正确的是
A.该化合物的分子式为C16H12O6
B.该化合物水解可生成醇类化合物
C.跟1mol该化合物反应的H2和NaOH的最大值分别是6mol和2mol
D.该化合物所有原子可能在同一平面上
第Ⅱ卷(非选择题 共50分)
18.下列关于铜电极的叙述,正确的是 ( )
A.铜锌原电池中铜为正极,发生还原反应
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用精铜作阳极
D.电解稀H2SO4制H2、O2时,可用铜作阳极
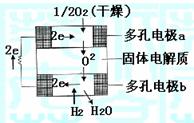 19.固体氧化物燃料电池是由美国西屋(West-inghouse)
19.固体氧化物燃料电池是由美国西屋(West-inghouse)
公司研制开发的。它以固体氧化锆一氧化钇为电解质,
这种固体电解质在高温下允许氧离子(O2-)在其间
通过。该电池的工作原理如右图所示,其中多孔电极
a、b均不参与电极反应。下列判断正确的是
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
 C.a极对应的电极反应为O2+2H2O+4e-=4OH-
C.a极对应的电极反应为O2+2H2O+4e-=4OH-
D.该电池的总反应方程式为2H2+O2 2H2O
2H2O
17.A、B、C三种短周期元素,原子序数按A、B、C依次增大,A元素原子最外层电子数是次外层电子数的2倍,B元素原子的次外层电子数是最外层电子数的2倍,C元素原子的最外层电子数是内层电子总数的一半。则下列说法中正确的是 ( )
A.A元素的气态氢化物都是含极性键的非极性分子
B.B元素在自然界的含量最多
C.C元素可以组成不同的单质,它们互为同素异形体
D.A、B、C的氧化物都能溶于水形成酸
16.下列各组物质性质比较中正确的是 ( )
A.溶解度:H2CO3<Na2CO3<NaHCO3 B.氧化性:Cs+<K+<Na+<Mg2+
C.酸性:H4SiO4<H3PO4<H2SO4<HClO D.稳定性:SiH4<CH4<NH3<HF
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com