
题目列表(包括答案和解析)
7.高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是( )
A.臭氧和氧气是氧的同素异形体 B.臭氧的存在对人体有害无益
C.臭氧可使湿润的淀粉KI试纸变蓝 D.臭氧是很好的消毒剂和脱色剂
5.下列单质中,最容易跟氢气发生反应的是 ( )
A.F2 B.O2 C.Cl2 D.N2
|
①白磷保存在冷水中,②Na保存在CCl4中 ③HF溶液保存在塑料瓶中,④AgNO3固体
保存在棕色试剂瓶内,⑤浓硝酸保存在溶液棕色广口瓶内
A.①③④ B.③④ C.①②③④ D.①②③④⑤
4.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是 ( )
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
3.下列说法中正确的是 ( )
A.酸性氧化物都是非金属氧化物
B.含有极性键的分子一定是极性分子
C.含有离子键的化合物一定是离子化合物
D.所有物质中都存在化学键
2.2006年12月1日为世界第19个艾滋病日,调查结果显示全国艾滋病病毒感染者人数在
不断地上升。医学界通过放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可
断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是 ( )
A.14C原子与C60中普通碳原子的化学性质不同
B.是C60的同素异形体
C.14C原子与14N原子所含中子数相同
D.与12C、13C是碳元素的三种同位素
1.我国科学家成功地合成了3mm长的管状碳纳米管,长度居世界之首。这种碳纤维具
有强度高、刚度(抵抗变形的能力)高、密度小(只有钢的1/4)、熔点高,化学稳定性
好的特点,因此被称为“超级纤维”。下列对碳纤维的说法中不正确的是 ( )
A.它是制造飞机的理想材料 B.它的主要组成是碳元素
C.它的结构与石墨相似 D.碳纤维复合材料不易导电
26.(10分)有机化合物A广泛存在于水果肉中,尤以苹果、葡萄、西瓜、山楂内为多。已知:
①A中碳和氢的质量分数之和为40.3%,其余为氧;其相对分子质量大于110,小于150。
②A与乙酸或丙醇在浓硫酸、加热的条件下生成有香味的产物;
③1molA与足量的钠最多能产生1.5mol气体;
④A在一定温度下脱水得到产物B(不是环状化合物),B可以和溴水发生加成反应。
试回答:
(1)A的分子式为 。
(2)对A的结构可作出的判断是 (多选扣分)。
(a)肯定有碳碳双键 (b)有两个羧基
(c)肯定有羟基 (d)有-COOR官能团
(3)有机物A的结构简式(不含-CH3)为 。
(4)A在一定温度下脱水产物B具有反异构现象,B和溴水反应的化学方程式:
。
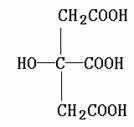 27.(10分)柠檬酸结构简式如下:
27.(10分)柠檬酸结构简式如下:
若将柠檬酸加热到150℃,则分子内失去一分子水而形成不饱和酸--顺乌头酸,后者在一定条件下和水反应又生成柠檬酸和异柠檬酸两种异构体。
(1)写出顺乌头酸和异柠檬酸的结构简式:
顺乌头酸: ,异柠檬酸:
(2)由柠檬酸转化为顺乌头酸的反应过程,属于 反应(填反应类型),
顺乌头酸转化为柠檬酸和异柠檬酸的反应过程,属于 反应(填反应类型)。
(3)传统塑料增塑剂为邻苯二甲酸双酯(DEHP)。因其结构中含苯环,可能致癌。柠檬酸酯无毒无味,可替代传统增塑剂。请写出用柠檬酸合成柠檬酸三乙酯(TEC)的化学式:
。
25. (10分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),
(10分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),
△H=-92.44kJ/mol;其部分工艺流程如下:
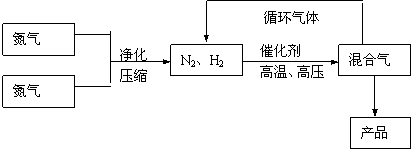
反应体系中各组分的部分性质见下表:
|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度升高,K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反映速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
24.(10分)二氧化钛最重要的用途是用于制造钛的其他化合物。由二氧化钛直接制取金属钛是比较困难的,原因是二氧化钛的热稳定性很强。例如:用碳还原二氧化钛,即使在高温1800℃也难反应。现用钛铁矿石为原料,经过一系列的反应制得颜料钛白粉(TiO2),其工业流程图大致如下:
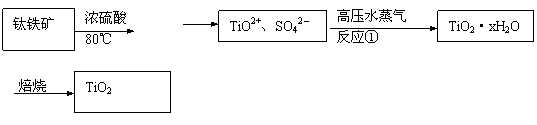
……
(1)反应①的离子方程式为 ,高压水蒸气的作用是
。
(2)用金红石主要成分(TiO2)制取颜料钛白粉(TiO2),涉及的工业流程大致如下:
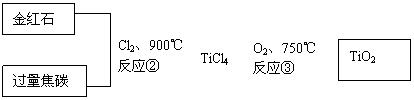


反应②的化学方程式 。
反应③的化学方程式 。
23.(10分)(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:
 在以上反应中Fe3+实际上起着
作用,总反应式为
在以上反应中Fe3+实际上起着
作用,总反应式为
。
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:
H2O2+I2=2HIO, 。
总反应式为 。
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为: 。
(4)铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是
。
(5)铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:
Fe2O3 + NaNO3+ NaOH → Na2FeO4+ NaNO2+ H2O
配平化学方程式,并标出电子转移的方向和数目。
Fe2O3 + NaNO3+ NaOH → Na2FeO4+ NaNO2+ H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com