
题目列表(包括答案和解析)
6.一定量的稀硫酸与过量的锌反应,为减慢反应速率,且不影响生成氢气的总量,可向稀硫酸中加入适量的
A.硫酸钠溶液 B.氧化铁固体 C.硝酸钾溶液 D.硫酸铜固体
5.痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因是在关节滑液中形成尿酸钠晶体:Ur-(aq)+Na+(aq) NaUr(s),其中Ur-表示尿酸根离子,第一次关节炎发作大都在脚趾或手指的关节处,这说明
A.尿酸钠水溶液成酸性 B.尿酸钠晶体难溶于水
NaUr(s),其中Ur-表示尿酸根离子,第一次关节炎发作大都在脚趾或手指的关节处,这说明
A.尿酸钠水溶液成酸性 B.尿酸钠晶体难溶于水
C.该反应为放热反应 D.该反应为吸热反应
4.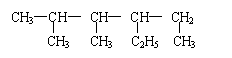 某烷烃的结构为:
,下列命名正确的是
某烷烃的结构为:
,下列命名正确的是
A. 1,2-二甲基-3-乙基戊烷 B. 3-乙基-4,5-二甲基已烷 C .4,5-二甲基-3-乙基已烷 D. 2,3-二甲基-4-乙基已烷
3.下列各项叙述正确的是
A. 同种元素组成的物质肯定属于纯净物
B.具有相同质子数的微粒都属于同种元素
C.一种元素可有多种离子,但只有一种电中性的原子
D.有新单质生成的化学反应,不一定都属于氧化还原反应
2.下列物质属于非电解质的是
A.CO2 B.H2O C.Cl2 D.CH3COOH
1.为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是
A.Mg2+ B.Ca2+ C.Na+ D.Fe3+
23.(10分)
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
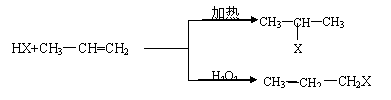
Ⅰ.
Ⅱ.苯的同系物与卤素单质混合,若在光照条件下,侧链上的氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
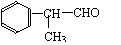
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
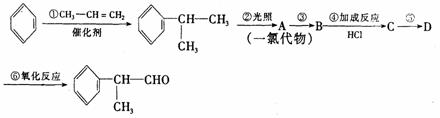
请根据上述路线回答下列问题:
(1)A的结构简式可能为 ;
(2)反应①、③的反应类型分别为 、 ;
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
;
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是
;
(5)这种香料具有多种同分异构体,其中某些同分异构体有下列特征:①其水溶液遇FeCl3溶液呈紫色;②分子中有苯环,且苯环上的一溴代物有两种。请写出符合上述条件的同分异构体可能的结构简式(只写两种):
。
22.(9分)为测定一置于空气中的某硫酸酸化的FeSO4溶液中的Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200 mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀27.96 g;再另取同样的FeSO4溶液200 mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0 g。
(1)计算该FeSO4溶液中各离子的物质的量浓度并填写下表:
.
|
c( H+)/mol-1 |
c( SO42-)/mol-1 |
c(Fe2+、Fe3+)/mol-1 |
|
|
|
|
注:表示Fe2+和Fe3+的总的物质的量浓度
(2)计算原溶液中Fe2+被氧化的百分率。
21.(8分)化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
请填写下列空白:
(1)常温下,NO分解产生O2的反应的平衡常数表达式为 ;
(2)常温下,水分解产生O2,此时平衡常数的数值约为 ;
(3)常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为
;
(4)随着轿车进入家庭,汽车尾气污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上有关数据分析,仅使用催化剂 (填“能”或“否”)消除污染气体。
20.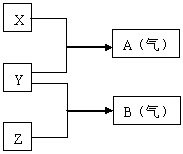 (7分)X、Y、Z为三种不同短周期非金属元素的单质。
(7分)X、Y、Z为三种不同短周期非金属元素的单质。
在一定条件下发生如右图所示反应。
请针对以下两种不同的情况回答:
(1)若常温下X、Y、Z均为气体,
且A和B在化合生成固体C时有白烟产生。则:
①Y的化学式是 ;
②生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A与B可
按物质的量之比2∶1反应生成Y。则:
①A与B的反应是氧化还原反应,Y是 产物;
②向苛性钠溶液中通入过量的A所发生反应的离子方程式为 ;
③将B与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com