
题目列表(包括答案和解析)
16.将20mL 0.4mol/L NH4NO3跟50mL 0.1mol/LBa(OH)2混合,则混合液中离子浓度的大小顺序是
A.c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
B.c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+)
C.c(Ba2+)>c(NO3-)>c(OH-)>c(NH4+)
D.c(NO3-)>c(Ba2+)>c(NH4+)>c(OH-)
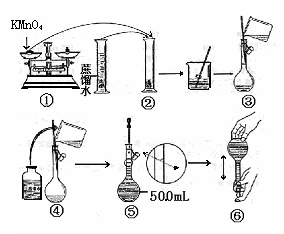 第Ⅱ卷(共52分)
第Ⅱ卷(共52分)
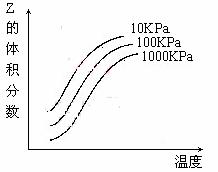
15.右图是温度和压强对X + Y  2Z 反应影响的示
2Z 反应影响的示
意图。图中横坐标表示温度,纵坐标表示平衡混合气
体中Z的体积分数。下列叙述正确的是
A.上述可逆反应的正反应为放热反应 B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
14.KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,
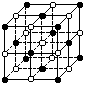 Cl-的位置用O
Cl-的位置用O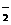 代替,下列对KO2晶体结构的描述正确的是
代替,下列对KO2晶体结构的描述正确的是
A.和K+距离相同且最近的O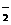 共有8个
共有8个
B.和K+距离相同且最近的K+共有6个
 C.和K+距离相同且最近的O
C.和K+距离相同且最近的O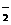 构成的多面体是正八面体
构成的多面体是正八面体
D.和K+距离相同且最近的O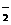 构成的多面体是正六面体
构成的多面体是正六面体
13.某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Ba2+、H+、Zn2+、SO42- B.MnO4-、K+、Cl-、H+、SO42-
C.Na+、Ba2+、NO3-、HCO3-、SO42- D.K+、NO3-、SO42-、OH-、Na+
12.下列离子方程式正确的是
A.碳酸氢钠溶液与少量石灰水反应 HCO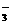 + Ca2+ + OH- = CaCO3↓ + H2O
+ Ca2+ + OH- = CaCO3↓ + H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热OH- + NH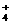 △ H2O + NH3↑
△ H2O + NH3↑
C.氢氧化镁与稀硫酸反应 H+ + OH- = H2O
D.单质铜与稀硝酸反应 Cu + 2 H++ 2NO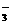 = Cu2+ + 2NO↑+H2O
= Cu2+ + 2NO↑+H2O
11.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.将NO2和N2O4分子共NA的混合气,气温降至标况下,其体积为22.4L
B.7.8gNa2O2与足量水充分反应转移电子数为0.2NA
C.同温同压下,体积均为11.2L的CO2和SO2所含有氧原子数为NA
D.新戊烷与异戊烷的混合物7.2g中所含共价键为1.6NA
10.有A、B、C三种短周期元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层数的3倍。由这三种元素组成的化合物的化学式不可能是
A.A3BC4 B.A2(BC4)3 C.A2BC3 D.ABC4
9.下列结论正确的是
①微粒半径:S2->Cl>S>F ②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性:S2->Cl->Br->I- ④单质氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se
A. 只有① B. 只有⑥ C. ②④⑥ D. ①③④
8.将标准状况下的某气体(摩尔质量为Mg•mol-1)溶于ag水中,所得到溶液的密度为bg•cm-3,物质的量浓度为cmol•L-1,则该气体溶入水中的体积是
A.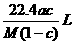 B.
B.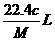 C.
C.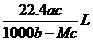 D.
D.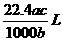
7.下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→ C(金刚石);ΔH=+1.9 kJ/ mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq) == H2O(l);ΔH=-57.3 kJ/ mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在101 kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g) + O2(g) == 2H2O(l);ΔH=-285.8 kJ/ mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com