
题目列表(包括答案和解析)
19.(10分),请按要求填空:
(1)下列实验操作或实验叙述正确的是 (填序号A、B、C、D)
①配制氯化亚铁溶液时,需加少量盐酸及铁粉;
②用10mL量筒量取5.80mL盐酸;
③用稀醋酸除去热水瓶内的水垢;
④检验卤代烃中卤素时,直接将卤代烃加入硝酸酸化的硝酸银溶液中
⑤金属钠着火可用干燥的细沙扑灭;
⑥用排水法收集氢气时,不需要检验纯度,可直接点燃;
⑦检验碳酸钠溶液中是否混有氢氧化钠可先加足量的氯化钙溶液,再滴入酚酞试液;
⑧可用过滤法除去氧氢化铁胶体中少量的氯化铁和盐酸。
A.①②③④⑥⑦⑧ B.①④⑥ C.⑤⑥⑦ D.①③⑤⑦
(2)测定有机化合物中碳和氢组成常用燃烧分析法,下图是德国化学家李比希测定烃类有机 物组成的装置,氧化铜做催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和高氯酸镁[Mg(C1O4)2]的吸收管分别吸收CO2和H2O。
试回答下列问题:

①甲装置中盛放的是 ,甲、乙中的吸收剂能否填倒?说明理由: 。
②实验开始时,要先通入氧气一会儿,然后再加热。为什么? ③若测得甲装置增重ag,乙装置增重bg,试求出烃中碳、氢原子个数比为: ④若已知试样是纯净物,某次测定时,测出碳、氢原子个数比为C:H=11:23,能否确 定其为何种烃? (填:能或不能);若能,写出其分子式 (若不能,此空不必回答)。
18.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
aHClO3===bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12+I2+6H2O==12H++10Cl-+2IO3-
C.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3 ====15O2↑+8C12↑+10HClO4+8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
第Ⅱ卷 (非选择题 共76分)
17. 在25mL0.mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓
在25mL0.mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓
度关系比较正确的
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)==c(CH3COO-)=c(OH-)==c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D。在D点:c(CH3COO-)十c(CH3COOH)==2c(Na+)
16.有编号为1、2、3、4的四瓶无色液体,仅知道是1%酚酞、0.1mol/LNaOH溶液、0.1mol/L盐酸和0.1mol/LNaCl溶液,现要求甲、乙、丙、丁四位学生进行鉴别,而且每人只鉴别两瓶溶液,告诉学生鉴别两瓶溶液都正确得满分,只有一瓶正确可以及格。四位学生的鉴别结果如下:
|
甲 |
1号为0.1mol/L盐酸 |
4号为0.1mol/LNaCl溶液 |
老师评价:四位学 生都及格,但是没 有一个得满分 |
|
乙 |
1号为0.1mol/LNaOH溶液 |
3号为0.1mol/L盐酸 |
|
|
丙 |
1号为1%酚酞 |
2号为0.1mol/L盐酸 |
|
|
丁 |
4号为0.1mol/L盐酸 |
2号为NaOH溶液 |
正确的结论是
A.1号为1%酚酞 B.2号为0.1mol/LNaCl溶液
C. 0.1mol/LNaOH溶液 D. 0.1mol/L盐酸
15.近年来研制的NF3气体可运用声氟化氢--氟化氚高能化学激光器中的氟源,也可作为火 箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3+3F2=NF3+3NH4F。
下列说法不正确的是
A.NF3的形成过程用电子式可表示为:
B. NF3的氧化性大于F2
C. NF3分子空间构型为三角锥形
D.NH4F中既有离子键又有极性共价
14.2005年2月14日新华社报道,我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池,。常见镍氢电池的某极是储氢合金LaNi5
(LaNi5H6中各元素化合价均为零),电池反应通常表示为
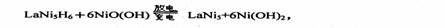
下列说法正确的是
A.放电时储氢合金作正极
B.充电时储氢合金作阴极
C.充电时阳极周围c(OH-)增大
D.放电时负极反应:
13.可用右侧示意图象表示的是
|
|
反应 |
纵坐标 |
甲 |
 乙 乙 |
|
A |
等质量钾、钠分别与水反应 |
H
2质量 |
钠 |
|
|
B |
相同质量氨,在同一容器中 2NH3  N2+3H2 N2+3H2 |
氨气的转化率 |
500℃ |
400℃ |
|
C |
体积比1:3的N2,H2,在体积可变的恒压容器中,2NH3 N2+3H2 N2+3H2 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
|
D |
2m01S02与lm0102,在相同温度下 2S02+02  2S03 2S03 |
S03物质的量 |
10atm |
2atm |
12.某短周期元素的最高价氧化物所对应的水化物的化学式为HxROY,气态氢化物的化学式为HzR(或RHZ)。已知1molHxROY比lmolHzR质量多64g。下列说法不正确的是
A.2Y-X+Z=8 B.Y=4
C.R一定是硫元素 D.R一定处于第三周期
11.某无色溶液中,若加入溴水,溴水褪色,若加入金属铝,铝溶解并产生大量氢气,则该溶液中可能大量存在的离子组是
A.Na+、OH-、S 2-、ClO- B.H+、Na+、Fe2+、NO3-
C.K+、Ba2+、OH-、SO32- D.Na+、K+、Ba2+、OH-
10.科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现了A1的超原子结构A113和A114,并在质谱仪检测到稳定的Al13I-等。A113、A114的性质很象现行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法不正确的是
A.All4与ⅡA族元素性质相似
B.A113与卤素性质类似
C.A113在气相中与HI反应的方程式可表示为:A113+HI=HAl13I
D.A113超原子中A1原子间是通过离子键结合的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com