
题目列表(包括答案和解析)
3.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是
A.在硫酸工艺流程中,对尾气中的SO2用过量的氨水吸收的反应
2 NH3·H2O + SO2 = 2NH4+ + SO32- +H2O
B.FeCl2在空气中被氧化 4Fe2+ + O2 + 2H2O = 4Fe3+ + 4OH-
C.工业上制备漂粉精的反应 Cl2 + 2OH- = Cl- + ClO- + H2O
D.FeBr2 (aq) 中通入少量Cl2 2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2 Br2 + 6Cl-
2.叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但撞击时会发生爆炸生成氮气。有关叠氮酸的叙述中正确的是
①NaN3 的水溶液呈碱性 ② HN3 的固体属于共价化合物
③NaN3 的固体属于离子化合物 ④NaN3可用于小汽车防撞保护气囊
A、①②③ B、②③④ C、①③④ D、①②③④
1、生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是
A、Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂。
B、用灼烧并闻气味的方法区别纯棉织物和纯毛织物。
C、某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2。
D、蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质。
23.(7分)为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下表:
|
实验次数 |
混合物的质量/g |
所加Ba(OH)2溶液的体积/L |
测得沉淀的质量/g |
|
1 |
0.858 |
0.5 |
1.379 |
|
2 |
1.716 |
0.5 |
|
|
3 |
2.574 |
0.5 |
4.137 |
|
4 |
3.432 |
0.5 |
5.516 |
|
5 |
4.290 |
0.5 |
5.516 |
|
6 |
5.148 |
0.5 |
5.516 |
请回答下列问题:
(1)第二次实验中产生沉淀的质量是 g。
(2)混合物中K2CO3和NaHCO3的物质的量之比为 。
(3)在25℃时,取下第3组实验所得溶液体积的1/10,加水配成500mL溶液,求此溶液pH(要求写出计算过程)。
22.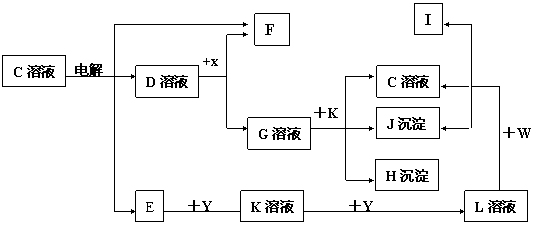 (7分)如图中C至L分别表示反应中的一种常见物质,E、F、I在通常情况下是气体单质,其中E有刺激性气体,X、Y是常见的金属单质.W是由甲、乙两种元素按1∶1组成,其中甲元素的原子M层电子数是K层的一半.乙元素的原子最外层电子数是次外层电子数的3倍,参加反应的水和生成的水已从图中略去.
(7分)如图中C至L分别表示反应中的一种常见物质,E、F、I在通常情况下是气体单质,其中E有刺激性气体,X、Y是常见的金属单质.W是由甲、乙两种元素按1∶1组成,其中甲元素的原子M层电子数是K层的一半.乙元素的原子最外层电子数是次外层电子数的3倍,参加反应的水和生成的水已从图中略去.
填写下列空白:
(1)E是______(化学式),X元素在周期表中的位置是 _(2)写出W的电子式_________
(3)写出K+G→H+J+C的离子方程式_____________________________________
(4)设计实验分离H和J(写出加入试剂和操作方法): ______________________________________
21. (10分)合成氨是重要的化学工业,为了研究合成氨的反应原理,在一密闭容器内充入1
mol N2和2 mol H2,在一定条件下,使之发生如下反应:N2(g)+3H2(g) 2NH3
(g)。
(10分)合成氨是重要的化学工业,为了研究合成氨的反应原理,在一密闭容器内充入1
mol N2和2 mol H2,在一定条件下,使之发生如下反应:N2(g)+3H2(g) 2NH3
(g)。
Ⅰ:若维持温度不变,且密闭容器的容积固定为1 L。
(1) 当此反应经过2 min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2 moL,则H2在2 min内的平均反应速率为__________________。
(2)如果开始时,向该容器内加入0.5 moL N2 ,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,则还必须加入H2 _______mol和NH3 _______mol。
(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol 、b mol 、c mol ,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是(a、b分别用含c的方程式表示) 。
Ⅱ:若温度维持不变,体系压强维持与Ⅰ相同,密闭容器的容积由1 L随反应进行而改变。
(4)开始时加入1 mol N2和2 mol H2,经过一段时间,容器中三种气体的物质的量分数不再发生变化时,则NH3的物质的量为__________(选填一个编号)
(甲)大于0.2 mol (乙)等于0.2 mol (丙)小于0.2 mol (丁)可能大于、等于或小于0.2mol
作出此判断的理由是__________________________________________。
20.(6分)据2002年3月5日的《环球时报》报道:意大利警方一举摧毁了四名摩洛哥人针对美国驻意大利大使馆的恐怖事件。警方从摩洛哥人的住宅中搜出了5kg爆竹,2.5kg蜡烛和2kgK4[Fe(CN)6]。据审讯,四名恐怖分子准备将爆竹作炸药,蜡烛作引爆剂,K4[Fe(CN)6]在爆炸中可分解成一种剧毒盐KCN。试根据要求回答下列问题:
(1)已知爆竹爆炸后,K4[Fe(CN)6]会发生分解,除生成剧毒盐KCN外,还生成三种稳定的单质。试写出化学反应方程式:
(2)恐怖分子打算将产生的剧毒KCN用来污染水源,含CN-的污水危害很大。处理该污水时,可将浓缩后含CN-的废水在催化剂TiO2作用下用NaClO氧化,使CN-的转化成CNO-的。CNO-在酸性条件下继续被NaClO氧化成N2与CO2,最后溶液中c(Cl-)增大。请写出上述反应的离子方程式 ; 。
19. (6分)在下列物质中:
① CH≡C-CH2-CH3 ②C3H8 ③CH3-C≡C-CH2-CH3 ④1,3-戊二烯⑤甲基环丁烷
⑥ ⑦
⑦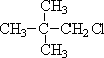 ⑧
⑧
属于同系物的是 ,属于同种物质的是 ,属于同分异构体的是 。
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;③将步骤②所得混合物过滤、洗涤,晾干后研细备用。回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是____________(填实验序号),步骤①、③中研磨固体所用仪器的名称是__________;
⑵步骤③中洗涤沉淀的操作是_______________________
 (二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2 g |
无其他物质 |
|
|
⑤ |
1.2 g |
CuO 0.5 g |
|
|
⑥ |
1.2 g |
MnO2 0.5 g |
|
回答下列问题:
⑶上述实验中的“待测数据”指_____________;
⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
⑸若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,(填后续操作)______________________________________
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,b.CuO的化学性质有没有改变.
17.(6分)右图是配制50mLKMnO4标准溶液的过程示意图。
请你观察图示判断其中不正确的操作有(填序号)______,其
中确定50mL溶液体积的容器是(填名称)______,如果按照
图示的操作所配制的溶液进行实验,在其他操作均正确的情况
下,所测得的实验结果将______(填偏大或偏小)。
18.(10分)某实验小组欲制取氧化铜并证明氧化铜能加快氯
酸钾的分解,进行了如下实验:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com