
题目列表(包括答案和解析)
2.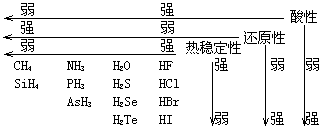 氢化物
氢化物
4.化学活性及反应
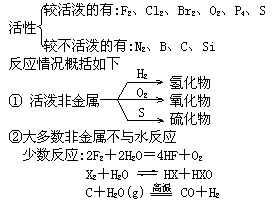
③非金属一般为成酸元素,难以与稀酸反应.
固体非金属能被氧化性酸氧化.

3.导电性
非金属一般属于非导体,金属是电的良导体,而锗、硅、砷、硒等属于半导体.但半导体与导体不同之一是导电率随温度升高而增大.
2.熔沸点与聚集态
它们可以分为三类:
①小分子物质.如:H2、O2、N2、Cl2等,通常为气体,固体为分子晶体.
②多原子分子物质.如P4、S8、As等,通常为液态或固态.均为分子晶体,但熔、沸点因范德华力较大而比①高,Br2、I2也属此类,一般易挥发或升华.
③原子晶体类单质,如金刚石、晶体硅和硼等,是非金属单质中高熔点“三角区”,通常为难挥发的固体.
1.单质:
(1)结构:除稀有气体外,非金属原子间以共价键结合.非金属单质的成键有明显的规律性.若它处在第N族,每个原子可提供8-N个价电子去和8-N个同种原子形成8-N个共价单键,可简称8-N规则;(H遵循2-N规则).如ⅦA族单质:x-x;H的共价数为1,H-H,第ⅥA族的S,Se、Te共价单键数为8-6=2,第ⅤA族的P、As共价单键数8-5=3.但第二周期的非金属单质中N2、O2形成多键.
(1) 除H外,非金属元素均在“阶梯线”的右上方
(2) 非金属元素(包括稀有元素)均在主族(零族)
(3) 最外层电子数一般≥4(H.B除外)
(4) 原子半径比同周期金属半径小.(稀有元素除外)
25.近年来,工业上用Mg(NO3)2代替浓H2SO4作为制取浓硝酸的吸水剂(以下数据为溶质质量分数)。65%的硝酸(质量为M1)中加入72%的Mg(NO3)2溶液(质量为M2)后蒸馏,
分别得到97.5%的硝酸和60%的Mg(NO3)2溶液(不含有硝酸)。
(1)若蒸馏过程中,硝酸、Mg(NO3)2和水均无损耗,求蒸馏前的投料比M1/M2值__________。
(2)若蒸馏过程中,水的损耗占总质量(M1+M2)的5.0%,则投料时,比值M1/M2__________
24.(12分)实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
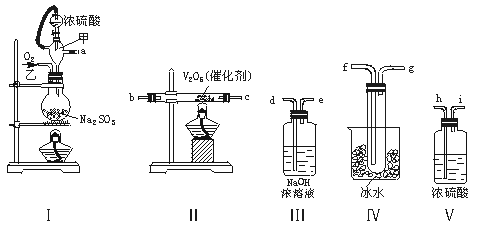
(1)这些装置的连接顺序(按气体左右的方向)是 → → → →
→ → → (填各接口的编号)。
(2)实验时甲仪器的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催
化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减
小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
23.(6分)某学生课外活动小组利用图所示装置分别做如下实验:在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是_______________。在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是___________。

22.(5分)有X、Y、Z三种元素:
(1)X、Y、Z的单质在常温下均为气体;
(2)X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
(3)XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红;
(4)每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
(5)Z单质溶于X2Y中,所得溶液具有漂白性。
试写出其元素符号:X_______,Y_______, Z_______,以及化合物的分子式: XZ_______,X2Y_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com