
题目列表(包括答案和解析)
26.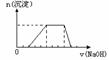 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是
(由少到多排列),且各离子的物质的量之比为
;肯定不含的阳离子是_______________。
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是
(由少到多排列),且各离子的物质的量之比为
;肯定不含的阳离子是_______________。
25.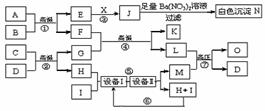 物质之间的转化关系如下图所示,A可作为工业生产J的原料,B、C、H、I为非金属单质,X的水溶液为一种常见的医用消毒液,F为常见的红棕色防锈油漆颜料的主要成分,O是常见氮肥,且反应⑦中L与M的物质的量之比为1∶2,A、E、J、N中含有同一种元素。回答下列问题:
物质之间的转化关系如下图所示,A可作为工业生产J的原料,B、C、H、I为非金属单质,X的水溶液为一种常见的医用消毒液,F为常见的红棕色防锈油漆颜料的主要成分,O是常见氮肥,且反应⑦中L与M的物质的量之比为1∶2,A、E、J、N中含有同一种元素。回答下列问题:
⑴X的化学式为 ,O的结构简式为 。
⑵考虑到综合经济效益,工业生产M时,可采取的措施有 (填序号)。
a.使用催化剂 b.适当降低温度 c.选择合适的温度 d.适度增大压强 e.及时分离出产物 f.对原料进行循环利用 g.充分利用反应本身放出的热量 h.工厂地址尽可能选择在交通发达的城市 j.工厂地址可选择在盛产天然气的地区
工业生产中为了节约资源、降低成本和保护环境,常常对某些物质进行循环利用。上述转化关系中能达到该目的的是 (填序号)。
⑶反应②化学反应方程式为 。
⑷现有1molA参加反应,假设各步均完全反应,生成N的质量为1165g,生成K的质量为224g,则
反应①化学反应方程式为 。
24.A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C都只有两个电子层,B中一层电子数是另一层的两倍;C中两层电子数之和是两层电子数之差的两倍;D中一层电子数是另两层电子数之和;E的正二价阳离子电子层结构与氩原子相同。请按要求回答下列问题:
⑴画出E原子的原子结构示意图 ,写出由A和C组成的含有非极性键的化合物的电子式 。
⑵由上述元素组成的化合物中属于极性键构成的非极性分子是
(只要求写出两种,用化学式表示)。
⑶由C与E形成的化合物高温时与单质B反应生成两种化合物,请写出该反应的化学方程式
⑷写出上述元素形成的化合物或者单质中:①一种可溶性的正盐与另一种强酸反应的离子方程式
②上述元素形成的化合物中通常能污染空气的是 (至少写出两种)。③某一种可污染空气的化合物与强氧化性单质常温下反应生成两种化合物,该反应的化学方程式为 。
23.某研究性学习小组研究HNO3的氧化性,设计了如下实验:
在盛有新制FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴入几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
⑴甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由
是 。
⑵乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。KSCN溶液是一种无色液体,根据C、S、N的原子结构和共价键的相关知识推测SCN-的结构式为 。
⑶根据乙同学的观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀,写出向浓HNO3中滴入KSCN的离子方程式
⑷丙同学认为SCN-的性质还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均消失变为黄色,而加入碘水时溶液的颜色基本不变。丙同学的设计意图是 __。
⑸通过本次探究,可以得出以下结论,a、用SCN-间接检验Fe2+时应注意 ;b、与SCN-反应使溶液变红的 是Fe3+。(填“一定”或“不一定”)
22.化学式为C8H10O的化合物A 具有如下性质:①A+Na→慢慢产生气泡 ②A+RCOOH 有香味的产物 ③A
有香味的产物 ③A 苯甲酸 ④催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成主要的“白色污染”源之一)。
苯甲酸 ④催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成主要的“白色污染”源之一)。
试回答:(1)根据上述信息,对该化合物的结构可作出的判断是
a苯环上直接连有羟基 b肯定有醇羟基 c苯环侧链未端有皿基 d肯定是芳香烃
(2)化合物A的结构简式
(3)A和金属钠反应的化学方程式
21.已知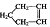 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为:
⑴降冰片烯属于__________。 a.环烃 b.不饱和烃 c.烷烃 d.芳香烃
⑵降冰片烯的分子式为__________。其二氯取代物共有 种。
⑶写出降冰片烯的所有含有一个六元环的单环化合物五种的同分异构体的结构简式
⑷降冰片烯不具有的性质__________。 a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
20.下列实验操作或对实验事实的描述不正确的是 (填序号)
A.用分液漏斗进行分液操作,将甘油和水的混合物分离; B.从溴的四氯化碳溶液中提取溴,可用苯进行萃取; C.用热的浓HCl洗涤附着有MnO2的试管; D.在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ; E.用碱式滴定管量得KMnO4溶液20.50mL ; F.实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置;
G.只用水一种试剂就能将CuSO4、Na2CO3、CaC2三种固体粉末鉴别; H.用NaOH溶液和FeSO4溶液制备Fe(OH)2时,吸有NaOH溶液的胶头滴管末端应插入FeSO4溶液液面之下.
19..0.1 mol·L-1盐酸分别跟20 mL NaOH和20 mL NH3·H2O反应,都消耗了20 mL盐酸,这表明NaOH溶液和氨水的关系
A. 物质的量浓度相同 B. 氢氧根离子浓度相同 C. pH相同 D. 溶液中离子浓度相同
18.NH4Cl溶液的pH和稀HCl的pH值均为5,其中由水电离出的c(H+)分别为amol/L和bmol/L则a与b的关系正确的是
A.a=b B.a<b C.a>b D.不能确定
17.Na2CO3溶液中,存在多种分子和离子,下列关系式中不正确的是
A. c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) B. c(Na+)> c(CO32-)> c(OH-)>c(HCO3-)>c(H+)
C. c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) D. c(OH-)+c(HCO3-)+2c(CO32-)=c(H+)+c(Na+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com