
题目列表(包括答案和解析)
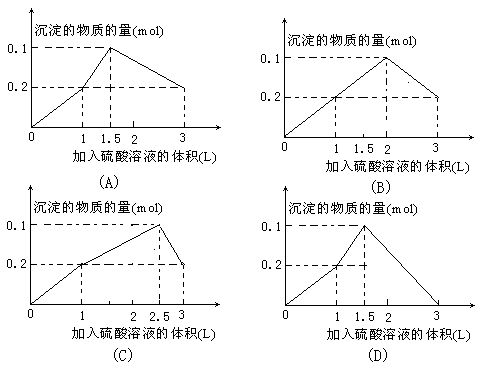
11.在1L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol·L-1的H2SO4溶液,所产生的沉淀的物质的量和所加入硫酸溶液的体积关系可用下列图像表示的是
10.下列各组离子,在指定环境中一定能大量共存的是
A.pH=7的溶液中:Al3+、K+、SO42-、HCO3-
B.加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3―
C.能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42-
D.由水电离出的[OH-]=10-13mol/L的溶液中:Fe3+、NH4+、ClO-、Cl-
9.青霉素试验针用它的稀溶液(200国际单位青霉素/mL)。现有1小瓶20万国际单位青霉素,1.0mL注射器(分刻度为0.1mL),注射用水和几个干净小瓶。现吸取1.0mL注射用水注入第1瓶内溶解青霉素。吸取0.1 mL溶液在第2 小瓶中用水稀释成1.0mL。再吸取0.1mL在第3小瓶中稀释成1.0mL。又……在第几小瓶中青霉素浓度为200国际单位/mL。
A.3 B.4 C.5 Dv6
8. 在传统的硝化法制硫酸中,其关键反应为NO2+SO2=NO+SO3,2NO+O2=2NO2,SO3+H2O=H2SO4。据此,对有关物质氧化性的相对强弱顺序判断正确的是
A.H2SO4> NO2> O2 B.O2> SO3> H2SO4 C.NO2> O2> SO3 D.O2> NO2> SO3
7. 对达到平衡状态的可逆反应:X+Y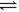 W+Z,在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间。下列有关X、Y、Z、W的状态叙述正确的是
W+Z,在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间。下列有关X、Y、Z、W的状态叙述正确的是
A.X、Y、W为气体,Z不是气体
 B.X、Y为气体,W、Z中有一种是气体
B.X、Y为气体,W、Z中有一种是气体
C.W、Z为气体,X、Y中有一种是气体
D.W、Z中有一种为气体,X、Y都不是气体
6.去西藏等高原而患脑水肿的患者吸入低浓度NO气体30分钟后即可清醒。但NO也因污染空气而“臭名昭著”,作为现代化城市引起的NO气体污染其主要来源是
A. 铜和稀硝酸反应 B.氮气和氧气发生反应
C. 二氧化氮气体溶于水 D. 氨的催化氧化
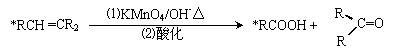 27(12分)碳碳双键有如下的断裂方式:
27(12分)碳碳双键有如下的断裂方式:
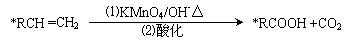
高分子单体A(C6H10O3)可进行如下反应(反应框图):
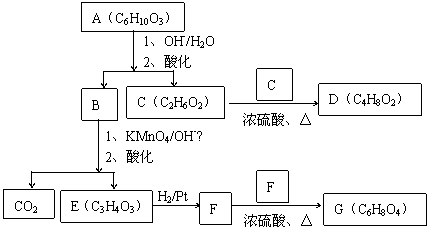
对框图中某些化合物性质说明:室温下A不与NaHCO3溶液反应,但可与Na反应放出H2;B可与NaHCO3溶液反应放出CO2;C可与Na作用放出H2而D不能;G在室温下既不与NaHCO3溶液反应,也不与Na作用放出H2。
⑴写出A、C、D、E的结构简式。
A: C: D: E:
⑵写出与B所含官能团相同的B的同分异构体:
⑶B在浓H2SO4存在下与甲醇反应的产物在一定条件下聚合,写出这个聚合物的结构简式:
。
⑷写出F→G的化学反应方程式: 。
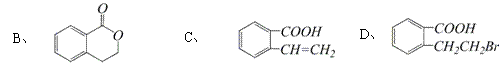 28(8分)有机物A的结构简式是
28(8分)有机物A的结构简式是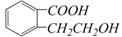 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
(1)A中官能团的名称是: 、
(2)写出由A制取B的化学方程式: 。
(3)写出A制取C、D两种物质的有机反应类型:C: D:
(4)写出两种既可以看做酯类又可以看做酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体中苯环上的取代基至少有一种不同)
; 。
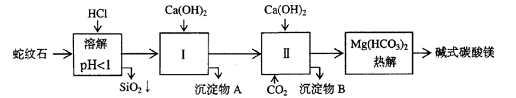
24(12分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
⑴蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
⑵进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见右表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解、 沉淀。
⑶从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
⑷物质循环使用,能节约资源。上述实验中,可以循环使用的物质是_________ (填写物质化学式)。
⑸现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③ ④ ⑤MgO称量
⑹18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:a=_________ b =_________ C =_________
25(10分)
⑴肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
。
 ⑵肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式是
⑵肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式是
。
负极的电极反应式是
。
⑶右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,
则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设
空气中氧气体积含量为20%)
⑷传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式
26(8分)已知氯化铝的熔点为190℃(2.5×105Pa),但它在180℃时即开始升华。
(1)氯化铝是 。(填序号 ①离子化合物 ②共价化合物)
(2)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L-1,试确定氯化铝在蒸气状态时的化学式为____________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是
(4)设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是
21(4分)用电石和水反应,产生的乙炔中含有H2S等杂质。某学生拟选用①NaOH溶液、②KMnO4溶液、③CuSO4溶液、④浓HNO3、⑤浓H2SO4中的一种除去H2S杂质,经研究最后他确定选用的溶液是 (填序号),如果没有该试剂,请你用其它试剂代替(写一种化学式) 。
22(10分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
⑴步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
⑵步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
⑶步骤④反应的离子方程式是 。
⑷步骤⑤中,某学生选择用苯来提取碘的理由是 。
⑸请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:
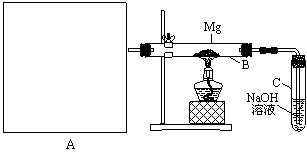 23(16分)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
23(16分)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
Ⅰ.用如上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。
⑴ 选择制取SO2的合适试剂____________。(填序号)
①10%的H2SO4溶液 ②80%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
⑵ 写出装置B中发生的主要反应的化学方程式_______________________________。装置C中NaOH溶液的作用是 。
⑶请画出制备SO2的发生装置并注明主要仪器的名称,固定仪器省略不画。
⑷你认为该装置不足之处是什么?
。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 ④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
⑸该小组“实验室制Si”的化学方程式是_____________________ ______________ 。
⑹你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是____ ______
20、密闭容器中,有反应:A +2 B  2C,产物C的生成情况如右图所示,a为40 MPa ,b为20 MPa时的情况,c为20MPa时从时间
2C,产物C的生成情况如右图所示,a为40 MPa ,b为20 MPa时的情况,c为20MPa时从时间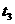 开始降低容器的温度情况,下列情况能满足图像变化,叙述正确的是
( )A、A、B、C均为气体,正反应吸热
开始降低容器的温度情况,下列情况能满足图像变化,叙述正确的是
( )A、A、B、C均为气体,正反应吸热
B、A、B、C均为气体,正反应放热
C、A和C为气体,为B非气体,正反应放热
D、C为气体,A、B中最少有一种为非气体,正反应放热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com