
题目列表(包括答案和解析)
29.(1)C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ;ΔH=-Q kJ/mol (3分)
(2)E F(2分) (3)①③(2分)
(4)A.CH3CH=CH2 , I.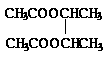 。(4分)
。(4分)
(5) 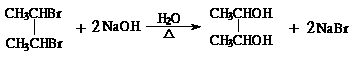 (3分)
(3分)
(6)  (4分)
(4分)
28.(1)CuO (2分) 氧化剂 (2分) CuO+CH3CH2OH → CH3CHO+Cu+H2O (2分)
CH3CHO + 2[Ag(NH3)2]+ + 2OH- → CH3COO- + NH4+ + 2Ag↓+ 3NH3 + H2O (2分)
|
CO+CuO =Cu+CO2(2分)
HCOOH+C2H5OH → HCOOC2H5+H2O (2分)
27.⑴He、Be(2分) ⑵ ACD (2分) ⑶ NaC8 (2分)
⑷2NH3 NH4++NH2- (2分) 正四面体 (2分)
NH4++NH2- (2分) 正四面体 (2分)
⑸品红 (2分) 褪色 (2分) (其他合理答案均可:酸性高锰酸钾溶液,溴水等)
|
26.⑴IO3-+5I-+6H+=3I2+3H2O (2分)
取食盐做焰色反应实验,若透过蓝色钴玻璃观察焰色呈紫色,说明有K+ (2分)
⑵阳极 (1分) I-+3H2O-6e-=IO3-+6H+ (2分) 变大 (1分)
(一)制取氧化铜
①称取2gCuSO4·5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀;然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色。
③将步骤②所得混合物溶解、过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是 (填实验步骤序号)。
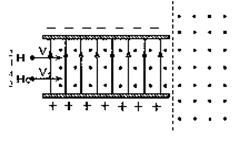
(2)步骤①、③中研磨固体所用仪器的名称是 。
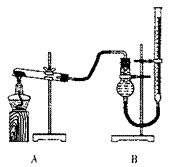 (二)证明氧化铜能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较。用右图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略。相关数据见下表:
(二)证明氧化铜能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较。用右图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略。相关数据见下表:
|
实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2g |
无其他物质 |
|
|
⑤ |
1.2g |
CuO 0.5g |
|
|
⑥ |
1.2g |
MnO2 0.5g |
|
回答下列问题:
(3)如何检查装置的气密性? 。
(4)上述实验中的“待测数据”指 ;
(5)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,然后 。
(6)为探究CuO在实验⑤中是否起催化剂作用,需要做以下实验(无需写出具体操作):
a.检验CuO的质量是否改变,b. 。
29.(16分) 已知 (注:R,R’为烃基)。
(注:R,R’为烃基)。
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
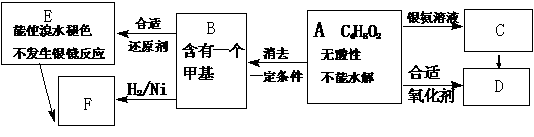
试回答:(1) A分子中的官能团是 。
(2) C→D的反应类型是 ,E→F的反应类型是 。(填字母序号)
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(3) 写出下列物质的结构简式: B. ; D
(4) 写出化学方程式:A→B 。
(5) 写出E生成高聚物的化学方程式: 。
(6) C的同分异构体C1与C有相同官能团,两分子C1脱去两分子水形成含有六元环的C2,
写出C2的结构简式: 。
30.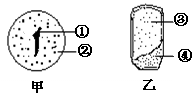 (20分)玉米是一种主要的农作物,为了提高玉米的产量,科学家在玉米育种的栽培中作了大量的研究。图甲是人工培育的玉米种子,图乙是玉米种子的纵剖面,请据图回答:
(20分)玉米是一种主要的农作物,为了提高玉米的产量,科学家在玉米育种的栽培中作了大量的研究。图甲是人工培育的玉米种子,图乙是玉米种子的纵剖面,请据图回答:
(1)图甲为人工培育的玉米种子,人工种子培育依据的原理是 ,经过 技术培育而成的。
(2)图乙是玉米种子的纵剖面,图甲中①相当于图乙中的[ ] ;图甲中的②
相当于图乙中的[ ] ,多数 植物种子没有图乙中③的结构。
(3)假如玉米子粒种皮的颜色紫色对白色为显性,把纯合的紫色子粒玉米的花粉授给纯合的白色子粒玉米,将得到的种子种下,长成植株所结种子的颜色是 。
(4)若供给玉米14CO2,则14C在玉米光合作用过程中,有机物将依次出现在
细胞和 细胞,若用碘检验,变蓝的细胞是 。
(5)科学家们正在积极探究减少使用氮肥而使玉米自行固氮的方法,即通过基因工程使固氮基因在玉米细胞中表达,提供目的基因的供体细胞与接受目的基因的受体细胞在结构上的主要区别是 ;在基因结构上,后者的基因 。
31.(22分)某研究性学习小组通过查阅资料,对几种植物的分生组织的细胞周期进行研究,获得的结果如下表:
|
|
细胞周期时间(h) |
||
|
植物 |
A时期 |
B时期 |
合计 |
|
物种Ⅰ |
⒑6 |
0.4 |
11 |
|
物种Ⅱ |
18 |
0.5 |
18.5 |
|
物种Ⅲ |
10.4 |
2.3 |
12.7 |
|
物种Ⅳ |
16.5 |
2 |
18.5 |
(1)你认为A时期属于细胞周期的 期,此时细胞内的遗传信息传递过程为 ,参与该过程的高分子化合物的基本组成单位分别是 。
(2)用光学显微镜观察有丝分裂过程,若从细胞周期考虑最好选用物种
的细胞作为实验材料,因为 。
(3)该小组还进一步探究了秋水仙素溶液对根尖细胞有丝分裂的影响。假如你是其中一员,请回答下列问题:
①实验材料用具:洋葱、显微镜、载玻片、盖玻片、广口瓶、剪子、滴管、玻璃皿(数个)、质量分数为15%的盐酸、体积分数为95%的酒精溶液、0.02g/mL 的醋酸洋红液、一定浓度的秋水仙素溶液。
②实验设计:
第一步: 。
第二步: 。
第三步: 。
第四步:将根尖染色并分别制成临时装片,然后放在显微镜下进行观察。
③观察到的现象: 。
④实验结果: 。
14.手机是常用通信工具,当来电话时,可以用振动来提示人们,振动原理很简单:是一个微型电动机带动转轴上的叶片转动.当叶片转动后,电动机就跟着振动起来了,从而带动手机振动起来,其中叶片的形状你认为是左下图中的哪种


15.用图所示的方法可以测出一个人的反应时间,设直尺从开始自由下落,到直尺被受测者抓住,直尺下落的距离 ,受测者的反应时间为
,受测者的反应时间为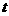 ,则下列说法正确的是:
,则下列说法正确的是:
A.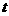 与
与 成正比 B.
成正比 B.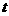 与
与 成反比
成反比
C.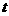 与
与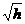 成正比 D.
成正比 D.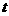 与
与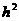 成正比
成正比
16.一辆汽车漏油,假如每隔2秒漏下一滴,车在平直公路上行驶,一位同学根据漏在路面上的油滴分布,分析汽车的运动情况(已知车的运动方向),下列说法中正确的是:
A. 当沿运动方向油滴始终均匀分布时,车可能做匀速直线运动
B. 当沿运动方向油滴间距逐渐增大时,车一定在做匀加速直线运动
C. 当沿运动方向油滴间距逐渐增大时,车的加速度可能在减小
D. 当沿运动方向油滴间距逐渐增大时,车的加速度可能在增大
17.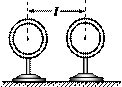 如图所示,两个完全相同的绝缘金属壳a、b的半径为R,质量为m,两球心之间的距离为l=3R。若使它们带上等量的异种电荷,电荷为q,那么两球之间的万有引力F引,库仑力F库分别为:
如图所示,两个完全相同的绝缘金属壳a、b的半径为R,质量为m,两球心之间的距离为l=3R。若使它们带上等量的异种电荷,电荷为q,那么两球之间的万有引力F引,库仑力F库分别为:
A.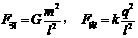 B.
B.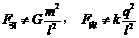
C.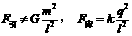 D.
D.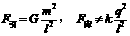
18. 如图所示,a、b、c是环绕地球在圆形轨道上运行的3颗人造卫星,它们的质量关系是ma= mb<
mc,则:
如图所示,a、b、c是环绕地球在圆形轨道上运行的3颗人造卫星,它们的质量关系是ma= mb<
mc,则:
A.b、c的线速度大小相等,且小于a的线速度
B.b、c的周期相等,且小于a的周期
C.b、c的向心加速度大小相等,且大于a的向心加速度
D.b所需要的向心力最小
19.如图所示,甲、乙是规格相同的灯泡,接线柱a、b接电压为U的直流电源时,无论电源的正极与哪一个接线柱相连,甲灯均能正常发光,乙灯完全不亮。当a、b接电压的有效值为U的交流电源时,甲灯发出微弱的光,乙灯能正常发光,则下列判断正确的是:
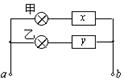 A.与甲灯串联的元件x是电容器,与乙灯串联的元件y是电感线圈
A.与甲灯串联的元件x是电容器,与乙灯串联的元件y是电感线圈
B.与甲灯串联的元件x是电感线圈,与乙灯串联的元件y是电容器
C.与甲灯串联的元件x是二极管,与乙灯串联的元件y是电容器
D.与甲灯串联的元件x是电感线圈,与乙灯串联的元件y是二极管
20.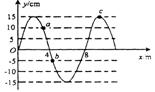 如图所示为某介质中一列简谐横波的图象,波速v = 2m/s,a、b、c为介质中三个相同的质点。以下所给的结论中正确的是
如图所示为某介质中一列简谐横波的图象,波速v = 2m/s,a、b、c为介质中三个相同的质点。以下所给的结论中正确的是
A.振源振动的频率为0.25Hz
B.若波沿x轴负方向传播,则质点a比质点b先回到平衡位置
C.图示时刻质点a、b、c的加速度大小之比为2 : 1 : 3
D.再经过1.0s,质点a、b、c通过的路程均为15cm
21.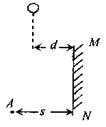 如图所示,MN是竖直放置的长L=1m的平面镜,在A处有观察者,一小球从某处自由下落。小球下落的轨迹与平面镜相距d=0.4m,观察者能在镜中看到小球像的时间t=0.2s。已知观察者的眼睛到镜面的距离s=1m。则小球从静止开始下落经多长时间,观察者开始在镜中看到小球的像。(g=10m/s2)
如图所示,MN是竖直放置的长L=1m的平面镜,在A处有观察者,一小球从某处自由下落。小球下落的轨迹与平面镜相距d=0.4m,观察者能在镜中看到小球像的时间t=0.2s。已知观察者的眼睛到镜面的距离s=1m。则小球从静止开始下落经多长时间,观察者开始在镜中看到小球的像。(g=10m/s2)
A.0.3s B.0.6s C.0.25s D.0.5s
第Ⅱ卷(非选择题,共174分)
22.(1)如图是《练习使用示波器》实验的示意图,图中“X输入”、“Y输入”、“地”为信号输入接线柱。实验要求用示波器测右图b、c间的直流电压。若把b接“地”接线柱,欲使P滑动时,亮斑在竖直方向移动,则c端应接 接线柱。实验发现,当p滑到最左端时亮斑恰好在荧光屏的中心;当P滑到最右端时,亮斑向下偏离中心3.0格。当P滑到某点时,亮斑向下偏离中心2.0格,则此时b、c间的电压为 V。
(图中电源是电动势为1.5V、内阻不计的一节干电池)
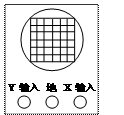

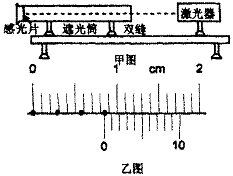
(2)某同学设计了一个测定激光的波长的实验装置如图,激光器发出的一束直径很小的红色激光进入一个一端装有双缝、另一端装有感光片的遮光筒,感光片上出现一排等距的亮点,乙图中的黑点代表亮点的中心位置。
①这个现象说明光具有 性。
②通过测量相邻光点的距离可算出激光的波长,如果双缝的缝间距离为d,双缝到感光片的距离为L。该同学测得L=1.0000m、d =0.220mm,用带十分度游标的卡尺测感光片的点间距时,尺与点的中心位置如乙图所示。乙图中第1和第4个光点的距离是 mm。实验中激光的波长λ= m。(保留两位有效数字)
③如果实验时将红激光换成蓝激光,屏上相邻两光点间的距离将 。
23.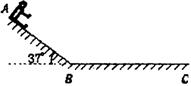 (16分)在海滨游乐场里有一种滑沙的游乐活动。如图所示,人坐在滑板上从斜坡的高处由静止开始滑下,滑到斜坡底端B点后沿水平的滑道再滑行一段距离到C点停下来。若某人和滑板的总质量m=60.0kg,滑板与斜坡滑道和水平滑道间的动摩擦因数相同,大小为μ=0.50,斜坡的倾角θ=37°。斜坡与水平滑道间是平滑连接的,整个运动过程中空气阻力忽略不计,重力加速度g取10m/s2。
(16分)在海滨游乐场里有一种滑沙的游乐活动。如图所示,人坐在滑板上从斜坡的高处由静止开始滑下,滑到斜坡底端B点后沿水平的滑道再滑行一段距离到C点停下来。若某人和滑板的总质量m=60.0kg,滑板与斜坡滑道和水平滑道间的动摩擦因数相同,大小为μ=0.50,斜坡的倾角θ=37°。斜坡与水平滑道间是平滑连接的,整个运动过程中空气阻力忽略不计,重力加速度g取10m/s2。
(1)(8分)人从斜坡滑下的加速度为多大?
(2)(8分)若由于场地的限制,水平滑道的最大距离为L=20.0m,则人在斜坡上滑下的距离AB应不超过多少?(sin37°=0.6,cos37°=0.8)
24(19分)如图一所示,abcd是位于竖直平面内的正方形闭合金属线框,金属线框的质量为m,电阻为R。在金属线框的下方有一匀强磁场区域, MN和M ′N ′是匀强磁场区域的水平边界,并与线框的bc边平行,磁场方向与线框平面垂直。现金属线框由距MN的某一高度从静止开始下落,图二是金属线框由开始下落到完全穿过匀强磁场区域瞬间的位移-时间图象,图像中坐标轴上所标出的字母均为已知量。v1、v2、v3、t1、t2、t3、t4皆代表坐标值。

求(1)金属框的边长;
(2)磁场的磁感应强度;
(3)金属线框在整个下落过程中所产生的热量。
25.(20分)如图在两水平放置的平行金属板之间有向上的匀强电场,电场强度为E.在两板之间及右侧有垂直纸面向外的匀强磁场,磁感应强度均为B.有两个带电粒子2 1H、4 2He(不计重力,不计粒子间的作用力),在同一竖直平面内以水平速度进入平行板,恰好都做匀速直线运动,射入点相距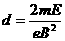 ,(其中e为元电荷电量,m为质子质量)。试求:
,(其中e为元电荷电量,m为质子质量)。试求:
(1)两带电粒子在右侧磁场中做圆周运动的半径。
(2)要使两粒子在离开平行板后能相遇,则两粒子射入平行板的时间差△t=?
26.(14分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A元素的原子是半径最小的原子.B元素的最高价氧化物对应水化物与其氢化物反应生成一种盐X.D与A同主族,且与E同周期.E元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、E这四种元素,每一种与C元素都能形成元素的原于个数比不同的若干种化合物.
请回答下列问题:
(1) ①写出元素的元素符号:B___________,C__________
②写出A与B形成化合物电子式_______________,其分子构型为______________。
(2)E的最高价态与A、B、C三种元素形成酸式盐Y的化学式是_________,该盐在水溶液中的离子浓度由大到小的顺序是_____________________________。
(3)常温时,B元素的最高价氧化物对应水化物Z的溶液与盐X的溶液的pH均为a,这两种溶液中由水电离出来的H+ 浓度分别用c1(H+)、c2(H+)表示,则c1(H+)∶c2(H+)=______。
27.(15分)A、B、C、D是化学中常见的单质,其中A是用量最大、应用最广泛的金属,D是地壳中含量最多的金属元素,甲、乙、丙为化合物,其中甲为黑色晶体,乙在常温常压下为无色无味的液体.它们之间存在如图所示的转化关系,由此可推知:
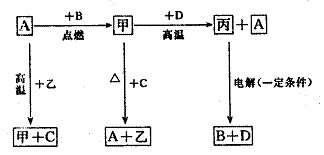
(1)元素D在周期表中的位置为 。
(2)写出甲和D反应的化学方程式(注明条件) ,
在此反应中生成1 mol A转移电子的物质的量为 mol;
写出引发此反应的实验操作: 。
(3)已知D能与烧碱溶液反应,写出D与烧碱溶液反应的离子方程式: 。
(4)元素A的高价氯化物常用于净水,请用离子方程式表示其净化原理: 。
(5)有一块A与D的合金,溶于足量盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥并灼烧后,完全变为红色粉末.称量,发现此红色粉末与原合金质量恰好相等.则合金中铝的质量分数为 。
28.(15分)某实验小组欲制取氧化铜,并证明氧化铜能加快氯酸钾的分解,进行如下实验:
13.用NA表示阿伏加德罗常数,下列叙述中正确的是
A.0.1mol·L-1稀硫酸100mL中含有硫酸根个数为0.1NA
B.1molCH3+(碳正离子)中含有电子数为10NA
C.2.4g金属镁与足量的盐酸反应,转移电子数为2NA
D.12.4g白磷中含有磷原子数为0.4NA
12.若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO- 3 Cl- B.K+ Na+ Cl- NO- 3
C.K+ Na+ Cl- AlO- 2 D.K+ NH+ 4 SO2- 4 NO- 3
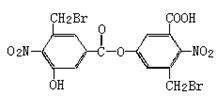
11.已知卤代烃在碱性条件下易水解。某有机物的结构简式如图:
则下列说法正确的是
|
B.向该有机物溶液中加入FeCl3溶液,振荡后有紫色沉淀产生
C.该有机物能发生消去反应
D.该有机物在稀硫酸中加热水解,有机产物只有一种
10.下列操作会使H2O的电离平衡向正方向移动,且溶液呈酸性的是
A.将纯水加热到95℃时,pH<7
 B.向水中加少量NaHSO4
B.向水中加少量NaHSO4
C.向水中加少量Na2CO3
D.向水中加少量FeCl3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com