
题目列表(包括答案和解析)
20.在反应SiO2+3C SiC+2CO中,氧化剂和还原剂物质的量之比是 ( )
A.1:3 B.3:1 C.1:2 D.3:1
第Ⅱ卷(非选择题,共60分)
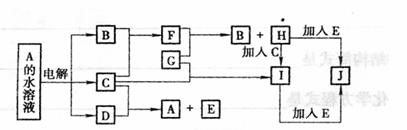 21.(12分)图中的每一方格表示有关的一种反应物或生成物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。已知常温下B、C为气态单质,G为固态单质,其余均为化合物。A是由2种短周期元素组成的离子化合物。B形成的氧化物的总电子数比F的总电子数少8,比A的总数少18。请填写下列空格:
21.(12分)图中的每一方格表示有关的一种反应物或生成物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。已知常温下B、C为气态单质,G为固态单质,其余均为化合物。A是由2种短周期元素组成的离子化合物。B形成的氧化物的总电子数比F的总电子数少8,比A的总数少18。请填写下列空格:
(1)E是 ,I是 ,I溶液蒸干灼烧得 (均填化学式)。
(2)写出C的水溶液与SO2反应的离子方程式 ,
(3)写出I+E→J在水溶液中反应的离子方程式 ,
|
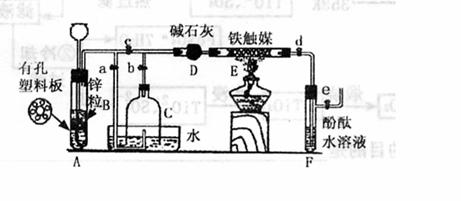 22.(14分)某化学小组在实验室模拟工业生产制备少量氨气,他们设计如下图所示装置(图中夹持装置均已略去)
22.(14分)某化学小组在实验室模拟工业生产制备少量氨气,他们设计如下图所示装置(图中夹持装置均已略去)
[实验操作]①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗中注入一定量稀硫酸,则A中有氢气生成。打开弹簧夹c、d、e,在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内液面下降到保持不变时,找开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内液面下降到保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大;此时再打开弹簧夹b的主要目的是 。
(3)在步骤③反应完成后,如果验证反应后的气体中还含有H2、N2?
|
19.下列各组热化学方程式中,化学反应的△H前者大于后者的是 ( )
①
②
③
④
A.① B.④ C.②③④ D.①②③
|
18.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.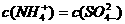 B.
B.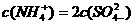
C.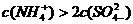 D.
D.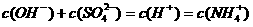
17.下列所采取的分离方法正确的是 ( )
A.由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
B.水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热的蒸馏法使含水酒精变为无水酒精
C.可用冷却热的饱和氯化钾和氯化钠的溶液的方法得到纯净的氯化钠晶体
D.由于胶体微粒的粒度比离子大,所以碘化钾混入淀粉中可用渗析法分离
16.有机化合物分子中双键上的碳原子与其他原子(或原子团)直接结合生成新的化合物分子的反应是加成反应。下列过程与加成反应无关的是 ( )
A.苯与溴水混合振荡,水层颜色变浅
B.裂化汽油与溴水混合振荡,水层颜色变浅
C.乙烯与水在一定条件下反应制取乙醇
D.乙烯与氯化氢在一定条件下反应取纯净的一氯乙烷
14.科学家发现了116号元素的一种稳定的核素,下列关于它的性质预测错误的是( )
A.它原子最外层有6个电子 B.它是主族元素
C.它具有-2、+4、+6价 D.它是一种金属元素
 15.右图是某有机分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子,该物质不具有的性质是 ( )
15.右图是某有机分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子,该物质不具有的性质是 ( )
A.与氢氧化钠反应
B.与稀硫酸反应
C.发生酯化反应
D.使紫色石蕊变红
13.溴化碘的分子式IBr,它的化学性质活泼,能与大多数金属反应,其与H2O反应的化学方程式为:IBr+H2O=HBr+HIO。下列叙述不正确的是 ( )
A.溴化碘为共价化合物
|
C.IBr与水的反应为非氧化还原反应
D.在化学反应中,IBr可以作为氧化剂
12.常温下,pH=2的盐酸和pH=2的醋酸等体积混合后,假设混合溶液的体积为盐酸和醋酸溶液的体积之和,则溶液的pH为 ( )
A.等于2 B.大于 2
C.小于2 D.无法确定
11.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大,电压高的特性。锂离子电池放电时的电极反应式为
负析反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++xe-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列说法错误的是
A.锂离子电池充电时电池反应为C6L1-x+LiMO2=C6Li+Li1-xMO2
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内Li+向负极移动
D.锂离子电池充电时阴极反应为:C6Li1-x+xLi++xe-=C6Li
10.下列金属①铁 ②镁 ③锰 ④钒 ⑤铬 可用铝热法制备的是 ( )
A.①②④ B.①②③⑤
C.①③④⑤ D.①②③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com