
题目列表(包括答案和解析)
8.表示下列变化的化学用语正确的是
 A.NaHCO3的水解:HCO3-+H2O H3O++CO32-
A.NaHCO3的水解:HCO3-+H2O H3O++CO32-
B.碳酸氢钠与另一盐溶液混和的双水解:HCO3-+ AlO2-+H2O = Al(OH)3↓+CO32-
C.铝粉撒入溶解有烧碱的重水中:2Al +2OH-+2D2O 2AlO2-+H2
2AlO2-+H2 +2D2
+2D2
D.1L0.5mol·L-1稀硫酸与1L 1mol·L-1氢氧化钠溶液反应放出57.3kJ的热:
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1) ; △H=-114.6 kJ/mol
7、已知298K时,2SO2(g)+O2(g)
 2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是
2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是
A、Q1=Q3=197kJ B、Q1=Q3<197kJ
C、Q1=2Q2 <197kJ D、Q2<Q1<197kJ
6.40℃时,等质量的两份饱和石灰水,一份冷却至10℃,另一份加少量CaO并保持温度仍为40℃,这两种情况都不改变的是
A.Ca(OH)2的溶解度 B.溶液的质量
C.溶质的质量分数 D.溶液中Ca2+数目
5.下列有关某些社会热点问题的说法中,错误的是
⑴禁止使用含铅汽油是为了提高汽油的燃烧效率;⑵臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关;⑶光化学烟雾的产生与人为排放氮氧化物有关;⑷空气质量预报目前主要是预报可吸入颗粒、二氧化硫、二氧化碳三种物质;⑸甲醛是某些劣质装饰板材释放的常见污染物之一;⑹硅肺病是由于长期吸入含二氧化硅粉尘引起的;⑺硅可用来制造集成电路、晶体管、硅整流器等半导体器件,还可制成太阳能电池。 A.⑴⑶⑷⑸⑺ B. ⑷ C.⑴ ⑷⑹ D.⑴ ⑷
4.2004年七月,德俄两国化学家共同宣布,在高压下,氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160kJ·mol-1,而N≡N键的键能为942 kJ·mol-1。则下列有关说法不正确的是
A.键能越大说明化学键越牢固,所构成的物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N):n(N-N)=1:3
D.用作炸药或高能材料可能是高聚氮潜在的应用
3.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
 A.CaC2+H2O→Ca(OH)2+CH≡CH↑ B. Na2O2+2H2O=4NaOH+O2
A.CaC2+H2O→Ca(OH)2+CH≡CH↑ B. Na2O2+2H2O=4NaOH+O2
C.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ D.NH4Cl+NaOH NaCl+H2O+NH3↑
2、市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质、油渍遇到它,皆能水解而除去,下列衣料中不能用加酶洗衣粉洗涤的是
①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥绵纶织品
A、②④ B、①②③ C、③④⑤ D、③⑤⑥
1、被称为“21世纪金属”的钛金属(Ti)有多种同位素,如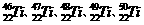 等。这些同位素原子的中子数不可能为
等。这些同位素原子的中子数不可能为
A、30 B、28 C、26 D、24
24. (12分)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0,现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。根据下图,回答下列问题:
(12分)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0,现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。根据下图,回答下列问题:

(1)图中共有两条曲线X和Y,其中曲线 表示N2O4浓度随时间的变化a、b、c、d四个点中,表示化学反应处于平衡状态的是
,并计算该点时反应的平衡常数为
。
(2)反应进行到25min时,曲线发生变化的原因是
;若要达到最后相同的化学平衡状态,在25min时还要以采取的措施是 。
A.升高温度 B.缩小容器体积
C.加入催化剂 D.加入一定量的N2O4
说明:下列25、26两小题是选考部分的内容,考生只需选答其中一小题,若选答两小题,则只按25小题计分。
 25.(10分)工业以上石油裂解得到的乙烯和1,3 – 丁二烯为原料,通过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
25.(10分)工业以上石油裂解得到的乙烯和1,3 – 丁二烯为原料,通过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
请按要求填空:
(1)写出下列反应的反应类型:① 反应,⑧ 反应。
(2)写出③④中某一步反应是与HC1的加成反应,该反应是 (填反应序号);设计该步反应的目的是
。
(3)物质D的结构简式是 。
(4)反应⑨的化学方程式式是 。
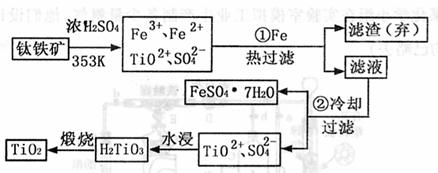 26.(10分)钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
26.(10分)钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
(1)步骤①加Fe的目的是 ;步骤②冷却的目的是 。
(2)上述制备TiO2的过程中,可以利用副产物是 ;考虑成本和废除物综合利用因素,废液中应加入 处理。
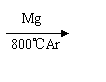
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiC14 Ti,反应
TiC14+2Mg=2MgC12+Ti在Ar气氛中进行的理由是
。
23.(12分)将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g),C(S),CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+ O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸汔反应的热化学方程式:
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1molC
(s)完全燃烧放出的热量多,甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出的下列循环图:
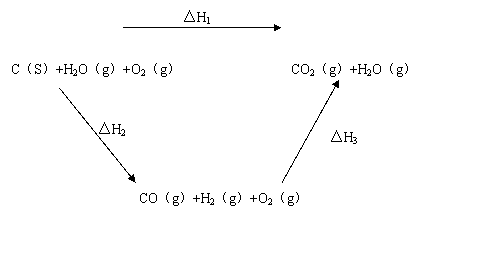
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”);判断的理由是
。
(3)将煤转化为水煤气为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述 (填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com