
题目列表(包括答案和解析)
3.下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
① C(s)+O2(g)=CO2(g);ΔH1
C(s)+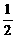 O2(g)=CO(g);ΔH2
O2(g)=CO(g);ΔH2
② 2H2(g)+O2(g)=2H2O(g);ΔH3 2H2(g)+O2(g)=2H2O(l);ΔH4
③ CaCO3(s)=CaO(s)+CO2(g);ΔH5 CaO(s)+H2O(l)=Ca(OH)2(s);ΔH6
A.①② B.①③ C.②③ D.只有②
2.下列各组物质的分类,正确的是
A.同位素:金刚石、石墨、C60
B.非电解质:Cl2、NH3、C2H5OH
C.非极性分子:N2、CO2、CCl4
D.同系物:  -OH、CH3-
-OH、CH3- -OH、CH3-
-OH、CH3- -CH2OH
-CH2OH
1.不会造成水污染的是
A.工业生产中废气、废液和废渣的排放
B.天然水与空气、岩石和土壤的长期接触
C.城市生活污水的大量排放
D.农业生产中,农药、化肥使用不当
29.(10分)利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,BAD的结构简式为:
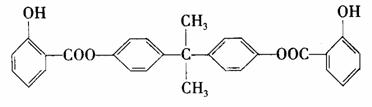
已知G不能发生银镜反应。BAD的合成路线如下:
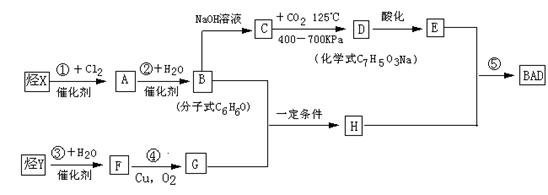
试回答下列问题
(1)写出结构简式:Y ;D 。
(2)属于取代反应的有 (填数字序号)。
(3)1 mol BAD最多可与含 mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④: ;
B+G→ H 。
28.(10分)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛外观似钢,具有银灰光译。钛的特性是强度大,密度小(4.51g/cm3),硬度大,熔点高(1675℃),自1791年英国牧师格列高尔发现钛至今,钛和钛的合金已被广泛用于制造飞机、火箭、卫星、宇宙飞船、舰艇、汽轮机、化工设备、电讯器材、人造骨骼等,被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第 周期,第 族;其基态原子的价电子层排布为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。
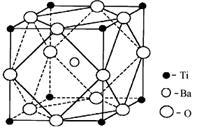
① 偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如下图,它的化学式是 。
② 已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品样配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
则绿色晶体的化学式为 ,绿色晶体中含有的化学键类型是 ,该配合物中的配位体是 。
27.以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
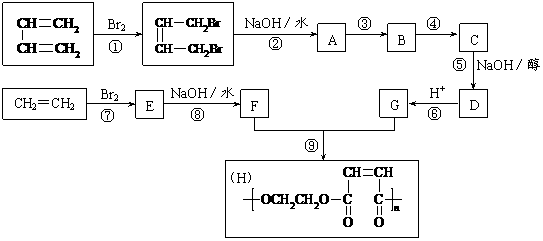
请按要求填空:
⑴写出下列反应的反应类型:
反应①________________,反应⑤________________,反应⑧________________ 。
⑵反应②的化学方程式:____________________________________________ 。
⑶反应③是与HCl加成,④是双重氧化,在③⑤中,设计③这一步反应的目的:________________ 。
(4)物质C的结构简式_________________,F的结构简式 。
26.(12分)
(1)物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
① 若X为氧化物,X的化学式是____________。
② 若X为单质,X用于焊接钢轨反应的化学方程式是_________________________。
③ 若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
X与稀硫酸反应的离子方程式是 ;
X与足量稀氢氧化钠溶液反应的离子方程式是 。
(2)在宇航器中,可以不断的将座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,以除去A。反应的化学方程式是 。
科学家设计出新的航天飞船内的空气更新系统。其中一步是A和氢气在200℃~250℃时,镍催化剂作用下,生成甲烷和另一种物质。该反应的化学方程式是____________。
25. (9分)在密闭容器中,保持一定温度进行如下反应N2(g)+3 H2(g) 2NH3(g)
2NH3(g)
,已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填序号)
A. N2的转化率越高
B. NH3的产量越大
C. 正反应进行得越彻底
D. 化学反应速度越快
(3)a与b的关系是:a b(填>、<、=)
(4)填写下表:
|
状态 条件 |
起始时物质的物质的量(mol) |
平衡时NH3的物质的量 (mol) |
|||
|
编号 |
X(N2) |
Y(H2) |
Z(NH3) |
||
|
恒容 |
① |
1 |
3 |
0 |
b |
|
② |
0 |
0 |
|
b |
|
|
③ |
|
2.25 |
|
b |
24.(7分)GaAs是一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第IIIA族,As位于周期表的第VA族。
(1)Ga和As的最外层电子数分别是 。
(2)GaAs中Ga和As的化合价分别是 。
(3)第IVA族的C和Si也可以形成类似的化合物半导体材料,该化合物半导体材料的化学式可表示为 。
23.(14分)已知氨气跟氧化铜反应可以制备氮气(2NH3+3CuO3Cu+3H2O+N2),纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即反应生成氢氧化镁和氨气.
(1)下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
A.氯化铵固体与消石灰共热 B.浓氨水逐滴加到新制的生石灰中
C.在一定条件下,氮气与氢气化合 D.加热分解氯化铵固体
你认为其中较简便易行的方案有 (填字母);其反应的化学方程式为
。
(2)该小组同学设计的制备氮化镁的方案有以下两个.分别见实验方案的装置图(夹持及加热仪器没有画出),且在实验前系统内的空气均已排除.
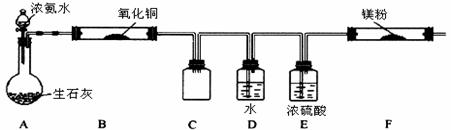 方案一:
方案一:
①该实验完成后,能否得到纯净的氮化镁 (填“能”或“不能”);简述理由 。
②装置C的作用是 。
方案二:已知:6NH3+3Mg3 Mg(NH2)2+3H2↑
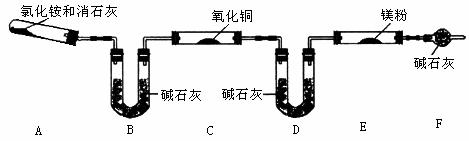
①该方案中存在的主要问题是 ;
②如何才能解决上述问题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com