
题目列表(包括答案和解析)
14.下列各种情况下,可以大量共存的离子组是……………………………………………( )
A.使pH试纸呈红色的溶液中:Fe3+ 、NO3- 、SO42- 、Na+
B.由水电离的c(H+)=1×10-14mol/L的溶液中:Ba2+ 、K+ 、Cl- 、HCO3-
C.与Al反应放出大量氢气的溶液中:NH4+ 、SO42- 、CO32- 、Na+
D.使紫色石蕊变蓝的溶液中:NH4+ 、Al3+ 、Ca2+ 、Cl-
13.X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+2。下列说法正确的是…………………………………………………………( )
A.X、Y、Z、W的原子序数依次增大
B.Y不能把溴从溴化物中置换出来
C.Z的氧化物通常形成分子晶体
D.存放W单质的仓库失火不能用CO2灭火
12.下列反应中,“加入的物质”能起催化作用的是…………………………………………( )
A.在H2O2分解反应中,“加入二氧化锰”后反应速率加快
B.在锌与稀硫酸反应中,“加入几滴硫酸铜溶液”后,反应速率会加快
C.漂白粉直接使用效果不太好,若加入“少许食醋”后可明显增强其漂白能力
D.实验室电解水时,“加入少量的氢氧化钠溶液”后,产生的气体速率加快
11.用NA表示阿伏加德罗常数,下列叙述中正确的是……………………………………( )
A.12 g金刚石晶体中含有碳碳键的数目为4NA
B.46 g四氧化二氮和二氧化氮的混合物中含有的原子总数一定为3NA
C.56 g铁粉与硝酸反应失去的电子数一定为3NA
D.将1 mol FeCl3制成胶体分散系,其中分散质粒子数为NA
10.有关溶液中所含离子的检验,下列判断中正确的是…………………………………( )
A.加入AgNO3溶液生成的白色沉淀不溶于稀盐酸,则原溶液中一定有Cl-存在
B.加入氨水时生成白色沉淀,当氨水过量时白色沉淀消失,则原溶液中一定有Al3+存在
C.加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+存在
D.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量CO32-存在
9.下列叙述正确的是…………………………………………………………………………( )
A.液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B.阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同
C.甲烷、白磷的分子都是正四面体结构,因此它们分子中化学键之间的夹角相同
D.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+11
8.下列各组物质用一种试剂不能加以鉴别的是……………………………………………( )
A.NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液
B.苯、苯酚溶液、己烯和乙醇
C.Na2SO4溶液、Na2SO3溶液、Na2CO3溶液、NaAlO2溶液
D.NaCl溶液、NH4Cl溶液、(NH4)2SO4溶液、Na2SO4溶液
7.在一定条件下,1g碳与适量水蒸气完全反应生成一氧化碳和氢气,需吸收10.94kJ的热量。则该条件下,相应热化学方程式的正确书写是下列的…………………………………( )
A.C+H2O CO+H2;△H=+10.94kJ/mol
B.C(s)+H2O(g) CO(g)+H2(g); △H=+10.94kJ/mol
C.C(s)+H2O(g) CO(g)+H2(g); △H=-131.3kJ/mol
D.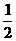 C(s)+
C(s)+ 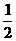 H2O(g)
H2O(g) 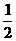 CO(g)+
CO(g)+ 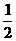 H2(g); △H=+65.64kJ/mol
H2(g); △H=+65.64kJ/mol
6.下列固体物质中不含X2n-离子的是………………………………………………………( )
A.Mg3N2 B.Na2O2 C.KO2 D.CaC2
5.糖类、油脂、蛋白质是人类重要的营养物质。下列说法正确的是………………………( )
A.葡萄糖不能跟新制的氢氧化铜反应生成红色沉淀
B.油脂在碱性条件下水解生成甘油和高级脂肪酸
C.蛋白质水解的最终产物是氨基酸
D.欲将蛋白质从水中析出而又不改变它的性质,应加入CuSO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com