
题目列表(包括答案和解析)
24.将一定量1.00mol/L CuSO4溶液和2.00mol/LNaOH溶液混合,得到一种浅绿色沉淀X。将0.499g X隔绝空气在1000℃以上强热,得到一种红色固体Y,质量为0.316g。Y溶于酸得到另一种红色固体0.141g。(Cu2O红色,Cu2O+2H+=Cu2++Cu+H2O)
(2)通过计算确定X和Y的化学式。
(1)混合时CuSO4和NaOH溶液的体积比为 ;
写出X→Y的反应方程式 。
23.
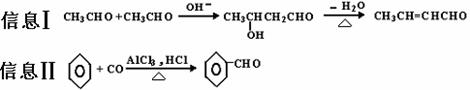
已知:下列有机化合物A~H有如图的转化关系:
化合物D的分子式为C10H10O,其苯环上的一氯代物只有两种;F的分子式为C10H9OBr。请回答下列问题:
(1)反应①的反应类型为 ,反应②的条件为 。
(2)化合物D有多种同分异构体,其中属于酚类,结构中除苯环外无其他环且苯环上只有两种互为对位的取代基的同分异构体有 种(不考虑两双键直接相连)。
 (3)以苯、丙醛为原料,其他无机试剂任选,写出制备化合物
(3)以苯、丙醛为原料,其他无机试剂任选,写出制备化合物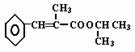 的合理流程图,注明试剂和条件。
的合理流程图,注明试剂和条件。
要求:合成反应流程图表示方法示例如下:
22.(为测定某有机化合物A的结构,进行如下实验。
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下)。则该物质中各元素的原子个数比是 ;
(2)如果A的相对分子质量为46,则该物质的分子式是 ;
(3)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式: 。
(4)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式: 。
(5)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式:
。
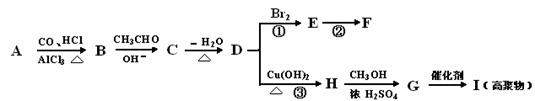
21.反应①②是重要的化工反应,D、E、F、G为单质,D、E、G、H为气体,且只有E为有色气体,F是常见的金属单质,G是空气中主要成分之一,K是白色胶状沉淀,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A-J中的物质:
(1)A的电子式 , H的结构式是 ;
(2)A溶液的电解方程式是 ;
C+B→J的离子方程式是 ;
(3)请设计F→K的最佳途径

(4)按设计得到1mol K,电解B时转移的电子数目是 ,至少需要另加试剂的物质的量是 : mol, : mol, : mol(可不填满)。
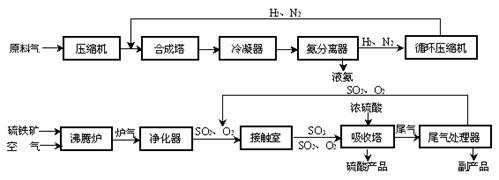
20.合成氨工业、硫酸工业的生产工艺流程大致为
合成塔和接触室中的反应分别为:N2(g)+3H2(g)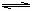 2NH3(g);△H<0 …………①
2NH3(g);△H<0 …………①
2SO2(g)+O2(g)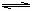 2SO3(g);△H<0 ………②
2SO3(g);△H<0 ………②
第一:进入合成塔和接触室中的气体都要进行热处理。最理想的热处理方法是 ;硫酸工业中炉气净化的目的是 。
第二:为提高原料利用率,合成氨工业和硫酸工业中都采取了 的措施。
③反应①在不同条件下反应达平衡时平衡混合物中NH3的体积分数如表1(反应开始时V(N2)∶V(H2)=1∶3), 反应②不同条件下反应达平衡时,SO2的转化率如表2(原料气成分:SO27%,O211%,N282%)。
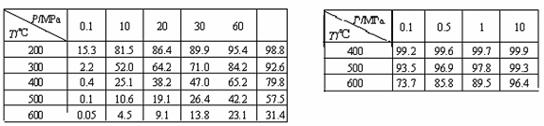 表1:
表2:
表1:
表2:
第一: 合成氨工业中,在500℃、30MPa时,合成塔中合成氨反应第一次达平衡时N2的转化率= 。
第二:反应①②正反应都是放热反应,但合成塔和接触室中的温度都控制在500℃左右,原因是 。
第三: 反应①②正反应都是气体体积缩小的反应,实际生产中合成氨采用高压而硫酸工业采用常压的原因是 。
19.环境的保护、废物的处理是一个综合的研究的课题,请根据各地区的实际情况回答下列问题:
(1)下列各项属于“绿色化学”的要求的是 。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某省为筹建一大型化工基地,征集到下列方案,其中你认为可行的是 。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便的远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。

在能制得铜的方案中,哪一步操作会导致环境污染?_________________。应增加哪些措施防止污染?____________________ ______。
(4)CO2的含量增多时会造成“温室效应”,那么 等气体也是造成“温室效应”的常见气体。请设计实验用图示表示某一气体造成“温室效应”。

18、 乙醛是一种常用的有机试剂,也象葡萄糖一样在碱性和加热条件下,能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,因此这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。同学们在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ、探究银镜反应的最佳实验条件(部分实验数据如下表):
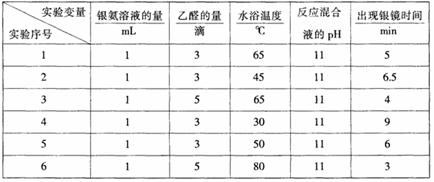
请回答下列问题:
(1)读表 若只进行实验1和实验3,其探究目的是 。
(2)推理 当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是 ;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的 。
(3)进一步实验 若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
。
Ⅱ、探究对废液的回收处理
银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程为:

操作④的方法是:把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉。反应的化学方程式为:Ag2S+Fe+2HCl2 Ag+ FeCl2+H2S↑
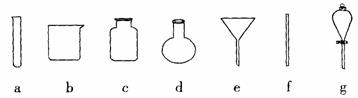
(4)若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为 ,需要用到的玻璃仪器有 (填编号)。
15.02+15.95)mL=15.24mL。试分析他的计算是否合理,如果不合理请说明理由。
____________________________________________________________________。
⑵乙同学用0.1000mol / LNaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表。
|
V(NaOH)/mL |
0.00 |
10.00 |
18.00 |
19.80 |
19.98 |
20.00 |
20.02 |
20.20 |
22.00 |
|
溶液pH |
2.88 |
4.70 |
5.70 |
6.74 |
7.74 |
8.72 |
9.70 |
10.70 |
11.70 |
 ①请作出pH-V(NaOH)图。
①请作出pH-V(NaOH)图。
②由表和图可知:在允许的误差范围(±0.1%)内,pH突变(滴定突跃)范围为____________。所以可选择____________作指示剂。
附:常见指示剂的变色范围
|
指示剂 |
变色的范围(pH) |
|
甲基橙 |
3.1-4.4 |
|
石蕊 |
5.0-8.0 |
|
酚酞 |
8.2-10.0 |
17.某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题。(有关实验药品为:市售食用白醋样品500mL、0.1000mol / LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液。)
Ⅰ.实验步骤:
⑴用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液。
⑵用酸式滴定管取待测食醋溶液20.00mL于 中。
⑶盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数。
⑷滴定,并记录NaOH的终读数。重复滴定2-3次。
Ⅱ.实验记录及数据处理
|
滴定次数 实验数据 |
1 |
2 |
3 |
4 |
|
V(样品)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)/mL(初读数) |
0.00 |
0.200 |
0.10 |
0.00 |
|
V(NaOH)/mL(终读数) |
14.98 |
15.20 |
15.12 |
15.95 |
|
V(NaOH)/mL(消耗) |
14.98 |
15.00 |
15.02 |
15.95 |
则c(样品)/ moL·L-1= ;样品总酸量g / 100mL= 。
Ⅲ.交流与讨论:
⑴甲同学在处理数据过程中计算得:V(NaOH)(平均消耗)=1/4(14.98+15.00+
16.有机物A和B均由C、H、O三种元素中的两种或三种组成,关于A、B两种物质的燃烧,其中正确的是
A.质量相等的A、B燃烧生成等质量的H2O,则可推知A、B具有相同的最简式
B.物质的量相等A、B燃烧生成等质量的H2O、CO2,则A、B必然互为同分异构体
C.物质的量、质量均相等的A、B燃烧生成等质量的H2O、CO2,则A、B必然互为同分异构体
D. 质的量相等的A、B燃烧耗氧量、生成的CO2均相等,则两者分子组成相差若干个“H2O”
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com