
题目列表(包括答案和解析)
28.(16分)双酚-A的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,其结构简式为:

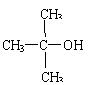 它在一定条件下水解可生成双酚-A和羧酸H两种物质。
它在一定条件下水解可生成双酚-A和羧酸H两种物质。
已知与 结构相似的醇不能被氧化为醛或酸。羧酸H可以由以下途径制得:

(1)双酚-A的分子式为 ;下列关于它的叙述中正确的是 (填写字母)。
A.与苯酚互为同系物
B.可以和Na2CO3溶液反应,放出CO2气体
C.分子中所有碳原子可能在同一平面上
D.与浓溴水反应,最多可消耗4mol Br2
(2)下列物质中与双酚-A互为同分异构体的是 (填写字母)。
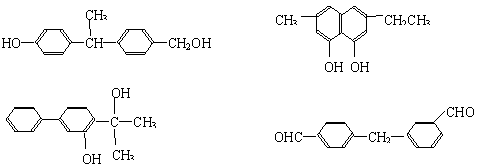
A. B.
C. D.
(3)C的结构简式 ,其名称为 。
(4)G中所含官能团为 (填名称),⑤的反应类型为 。
(5)反应③的化学方程式为 。
(6)羧酸H与甲醇反应后得到的酯,能形成一种高分子化合物,可用于制造高级光学仪器透镜,请写出该酯在一定条件下生成此高分子化合物的化学反应方程式:
。
13.有下列五个化学方程式(X、Y、Z均为正值):
 ①C2H2(g)+H2(g) C2H4(g)
①C2H2(g)+H2(g) C2H4(g)
|
 ②CH4(g) H2(g)+
②CH4(g) H2(g)+ C2H4(g)
C2H4(g)
 ③C(s)+2H2(g) CH4(g);△H=-X kJ·mol-1
③C(s)+2H2(g) CH4(g);△H=-X kJ·mol-1
 ④C(s)+
④C(s)+ H2(g)
H2(g)  C2H2(g);△H=-Y kJ·mol-1
C2H2(g);△H=-Y kJ·mol-1
 ⑤C(s)+H2(g)
⑤C(s)+H2(g)  C2H4(g);△H=-Z kJ·mol-1
C2H4(g);△H=-Z kJ·mol-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③-⑤式中关于X、Y、Z的大小顺序排列正确的是 ( )
A.X>y>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
第Ⅱ卷(非选择题)
26(18分)某同学用下列装置制备并检验Cl2的性质。
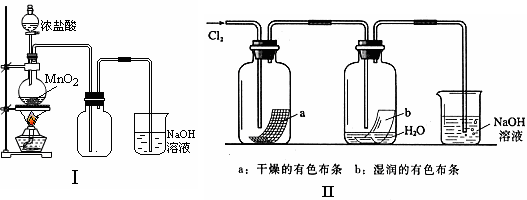
(1)I图圆底烧瓶中反应的化学方程式是 ;
(2)II图中褪色的是 (填a或b),烧杯中反应的离子方程式是
;
(3)①将Cu丝换成Fe丝,做III实验,结果也能点燃,你认为Fe丝也可点燃的理由
 是
。
是
。
a.Fe与Cu都是金属元素 b.Fe的熔点比Cu高
c.Fe的密度比Cu小 d.Fe的金属性比Cu强
②通常由燃烧产物(FeCl3)配制其溶液的方法
。
(4)将IV装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成,饱和食盐水中有少量固体析出,量筒内黄绿色气体颜色变浅 ,量筒内液面上升等。
1油状液滴的成分可能是(写分子式) ,
2水槽用饱和食盐水而不用水的原因是_________________________________。
3饱和食盐水中有少量固体析出,其原因是_____________________________。
(5)将硫酸溶液滴入II图烧杯中,至溶液显酸性,结果也有Cl2生成,该反应的离子方程式
是 。
27(13分)A-N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。回答下列问题:
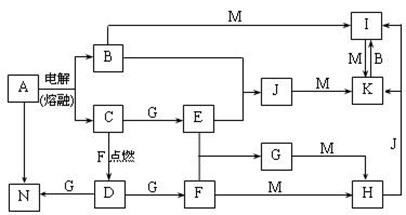
⑴H的化学式为________。
⑵工业上用A制取N的化学反应方程式为________________________________。
⑶D与G反应的离子方程式为_______________________________________。
⑷I可用于净化水,其原因是______________________________________________。
⑸用电子式表示J的形成过程:____________________________________________
12.关于下列各装置图的叙述中,不正确的是( )
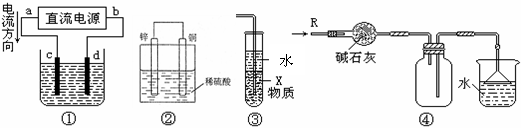 A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液。
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液。
B.装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
11.维生素C是具有抗衰老作用,在空气中容易被氧化。在新鲜水果,蔬菜,乳制品中含丰富的维生素C,某课外小组的同学利用碘滴定法测定某橙汁中维生素C的含量,反应的化学方程式为:
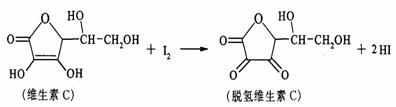
下列说法正确的是( )
A.上述反应为取代反应。 B.维生素C不能发生水解
C. 滴定时可用淀粉做指示剂 D.维生素C遇FeCl3溶液发生显色反应。
10. 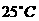 时,某物质的水溶液中由水电离出来的
时,某物质的水溶液中由水电离出来的 为
为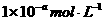 ,下列说法正确的是
,下列说法正确的是
A.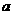 < 7时,水的电离被抑制 B.
< 7时,水的电离被抑制 B.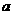 > 7时,水的电离被抑制
> 7时,水的电离被抑制
C.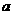 > 7时,溶液的
> 7时,溶液的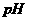 一定为
一定为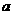 D.
D.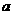 < 7时,溶液的
< 7时,溶液的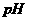 一定为
一定为
9.NA为阿伏加德罗常数,下列叙述正确的是 ( )
A.标准状况下11.2L臭氧中含NA个氧原子
B.1.8g重水(D2O)中含NA个中子
C.1 mol FeCl3转化成Fe(OH)3胶体时,有NA个Fe(OH)3胶粒生成
D.a mol Cl2与足量烧碱溶液完全反应转移的电子数为a NA
8.右表为元素周期表前四周期的一部分,下列有关R、W、
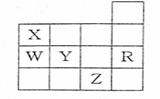 X、Y、Z五种元素的叙述中,正确的是( )
X、Y、Z五种元素的叙述中,正确的是( )
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子相同
C.Y元素的非金属性比W元素的非金属性强
D.W的氢化物的沸点X的氢化物的沸点高
7. 下列离子方程式中正确的是
A.少量CO2通入苯酚钠溶液中:
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至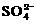 沉淀完全:
沉淀完全:
2H++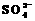 +Ba2++2OH-=BaSO4↓+2H2O
+Ba2++2OH-=BaSO4↓+2H2O
C.Fe(OH)3溶解于氢碘酸(HI)溶液中:Fe(OH)3+3H+=Fe3++3H2O
D.钢铁吸氧腐蚀的正极反应:4OH--4e-=O2↑+2 H2O
6.生活中的某些问题常常涉及化学知识。下列有关叙述不正确的是
A.甲醛是某些劣质装饰板材释放的常见污染物之一
B.棉花和蚕丝的主要成分都是蛋白质
C.臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且又不影响水质
D.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用,生成了可溶性的Ca(HCO3)2
25.电子工业常用一定浓度的FeCl3溶液腐蚀表面有铜箔的绝缘板,制成印刷线路板。现将一块敷有铜箔绝缘板浸入800 mL 某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入一定量的铁粉,充分反应后,仍有固体存在,将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00 mL,向其中滴入3.00 mol/L AgNO3溶液60.00 mL,溶液中的Cl-恰好完全沉淀。
(1)溶液A中FeCl3的物质的量浓度为 mol/L。
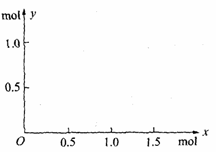 (2)假如铁粉不再溶解,向溶液B中加入铁粉的质量至少应大于
g。
(2)假如铁粉不再溶解,向溶液B中加入铁粉的质量至少应大于
g。
(3)若已知将表面有铜箔的绝缘板浸入800 mL某FeCl3溶液A中,溶解铜的32.0g,在反应后的溶液中加入铁粉x mol,随着铁粉的加入,析出铜为 y mol,请建立y和x的函数关系并利用函数关系作图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com