
题目列表(包括答案和解析)
13、下列叙述正确的是 ( )
A.同一主族的元素,原子半径越大,其单质的熔点越高;晶体熔化时,化学键不一定发生断裂
|
C.将pH=2,体积相同的盐酸和醋酸溶液均稀释100倍后,分别加入足量的相同颗粒大小的锌,产生H2的起始速率相同,醋酸放出的氢气多
D. 位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高化合价X<Y
第Ⅱ卷(非选择题)
12、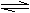 可逆反应A(g)+3B(g) 2C(g);△H<0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是( )
可逆反应A(g)+3B(g) 2C(g);△H<0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是( )
A.甲中A的转化率为75%
B.甲、乙中C的体积分数相同
C.达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动
 D.乙中的热化学反应方程式为2C(g) A(g)+3B(g);△H=+Q2
kJ·mol-1
D.乙中的热化学反应方程式为2C(g) A(g)+3B(g);△H=+Q2
kJ·mol-1
11、下列溶液中,能大量共存的离子组是
A.能使氢氧化铝迅速溶解的溶液:Na+、Fe2+、NO3-、SO42-
B.含有大量ClO-的溶液:H+、Mg2+、I-、SO42-
C. c(H+)=1×10-2mol·L-1的溶液:Na+、NH4+、CO32-、SO42-
D.含有大量SO42-的溶液:K+、Cu2+、Cl-、NO3-
10、合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
 N2(g)+3H2(g)
2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)
N2(g)+3H2(g)
2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)
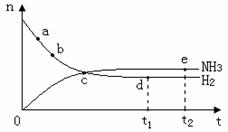
随时间变化的关系如右图,下列叙述错误的是( )
A.点a的正反应速率比b点的大
B.点c处反应还未达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,500℃下反应至t1时刻,
n(H2)比右图中d点的值大
9、.短周期元素A、B、C,原子序数
依次递增。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<B<C B.沸点:A的氢化物低于C的氢化物
C.B的硫酸盐溶液pH<7 D.5.6 g铁与足量的C化合,转移0.3 mol电子
7、下列叙述正确的是:
A. pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
B. 将25 °C纯水加热至95°C时,而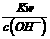 增大
增大
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D. 依据相对分子质量,一定能判断组成和结构相似的物质熔沸点的高低
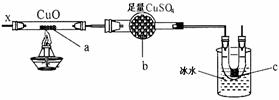 8、 按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体可能是( )
8、 按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体可能是( )
A.CH3CH2OH(气)B.NH3
C.CO和H2 D.H2
6、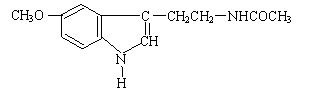 人体脑内有松果体腺,能分泌一种具有调节睡眠作用的物质,它的分泌量的大小随时间、光线、昼夜变化等条件的不同而变化,比如晚上分泌得多,白天分泌得少。这种物质叫松果体素,又叫褪黑素,也就是保健市场上出售的“脑白金”。脑白金的有效成分的结构简式如图所示,下列对该化合物的叙述正确的是
人体脑内有松果体腺,能分泌一种具有调节睡眠作用的物质,它的分泌量的大小随时间、光线、昼夜变化等条件的不同而变化,比如晚上分泌得多,白天分泌得少。这种物质叫松果体素,又叫褪黑素,也就是保健市场上出售的“脑白金”。脑白金的有效成分的结构简式如图所示,下列对该化合物的叙述正确的是
A.它属于氨基酸
B.它属于高分子化合物
C.分子式为C13N2H14O2
D.在一定条件下可以发生加成反应和水解反应
29、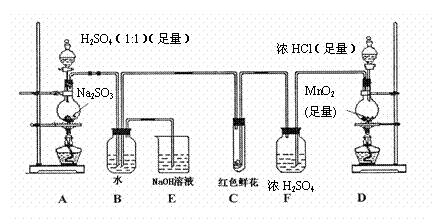 (14分)某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
(14分)某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
回答下列问题
(1)写出A装置中玻璃仪器的名称:酒精灯、 。
(2)实验开始后,写出B中反应的离子方程式 。
 (3)C中的现象是
,E装置的作用是
。
(3)C中的现象是
,E装置的作用是
。
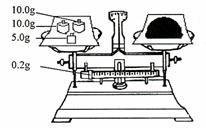
(4)按右图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应。然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g,则原样品中Na2SO3的纯度为 (精确到0.1%)。
(5)在过滤沉淀时若过滤液出现浑浊,则必须要重复操作,若该学生没有重复过滤,则测定的结果
将 (填“偏高”、“偏低”或“无影响”)。
(6)要使测定结果准确,第一:装置气密性必须良好;第二:应先点燃 处酒精灯(填装置字母)。
28、(21分)已知 (注:R、R’为烃基)
(注:R、R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
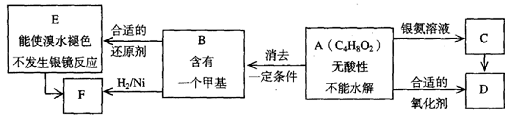
试回答:
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性 ,b.能发生水解反应 ;
(2)A分子中的官能团是(写名称) ,D的结构简式是 ;
(3)C→D的反应类型是 ,E→F的反应类型是 (写编号);
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(4)写出A→B化学方程式 ;
(5)写出E生成高聚物的化学方程式 ;
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式 。
27、 (10分)在容积相同的不同容器中,分别充入等量的按体积比1:1混合的N2和H2,在不同温度下发生反应N2 + 3H2
(10分)在容积相同的不同容器中,分别充入等量的按体积比1:1混合的N2和H2,在不同温度下发生反应N2 + 3H2 2NH3,并在第10s时分别测定其中NH3的体积分数并绘成如下图的曲线。
2NH3,并在第10s时分别测定其中NH3的体积分数并绘成如下图的曲线。
(1)A、B、C、D、E五点中,尚未达到化学平衡的点是__________;
(2)该可逆反应的正反应是_______(填“吸热”或“放热”)反应。
(3)由T1 向T2变化时,v正_______v逆(填>、<或=,下同);由T3向T4变化时,v正_______v逆。
(4)已知E点对应的纵坐标为20%,问E点混合气体的平均相对分子质量是_________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com