
题目列表(包括答案和解析)
4.向NaBr、NaI、Na2SO3混合液中,通入-定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
A NaCl NaI Na2SO4 B NaCl Br2 Na2SO4
C NaCl Na2SO4 I2 D NaCl Na2SO4
3.类推的思维方法在化学学习和研究中是一种常用的思维方法,但有时会产生错误的结论,因此类推出的结论最终要经过实践检验才能决定其正确与否。下列几种类推结论中正确的是
A.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
C.由于HF分子间存在氢键,其沸点反而高于HCl;NH3间也存在氢键,其沸点也应高于PH3
D. 1molNaCl在水溶液中可电离产生1mol Na+;则1mol FeCl3在水溶液中也能电离产生1molFe3+
2.根据下列事实所列出的相应结论正确的是
|
|
实 验 事 实 |
结 论 |
|
A |
NH3的水溶液可以导电 |
NH3是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:>Al(OH)3 |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
1.物质发生化学反应时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是 ( )
A.①②⑤ B.②③⑥ C.①②③ D.④⑤⑥
28、(12分)1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:RX+Mg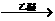 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
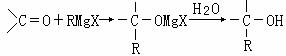
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有一定对称性。合成线路如下:
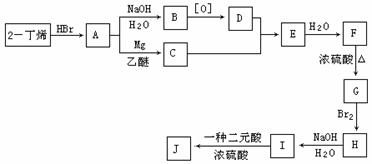
请按要求填空:
(1)3,4-二甲基-3-己醇是: (填代号),E的结构简式是 ;
(2)C→E的反应类型是 ,F→G的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B
I→J
27. (8分)从某些植物树叶提取的挥发油中含有下列主要成分:
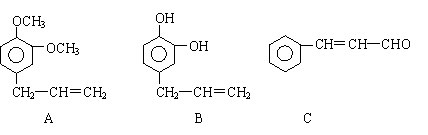
(1)写出A的分子式 。
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)写出C满足下列条件的同分异构体3种:①含苯环且其环上有两个取代基
②遇FeCl3溶液发生显色反应。 ; ; 。
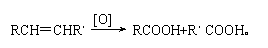
(4)已知: 写出C在强氧化剂条件下生成的有机化合物的结构简式 。
25.(10分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。W是由两种短周期元素组成,其与水的反应可类比电石与水的反应。乙通常是一种红棕色粉末。G为白色胶状沉淀。W、G、H、I三种物质中都含有同一种的短周期金属元素。A在常温下为气态,与氧气完全反应时的体积比是1∶2。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
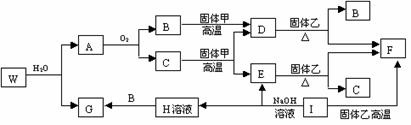

⑴ B的电子式为 ,I原子的结构示意图______________。
⑵ 有上述转化关系图中,C→E、D→F、E→F、I→F、I→E、A→B 等反应中有多个反应属于置换反应,根据要求写出反应式。
非金属元素之间的置换反应____________________________________________;
金属单质置换非金属的置换反应________________________________________;
⑶ 写出W和水反应的化学方程式_________________________________________。
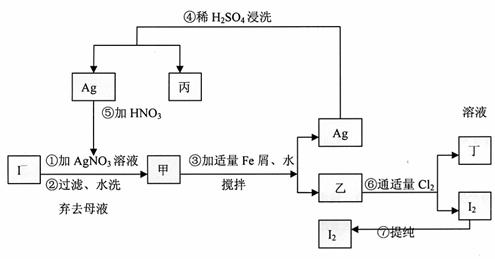 26.(14分)在已知提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
26.(14分)在已知提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
试回答:
(1)乙、丁中溶质的分子式:乙 ,丁 。
(2)第④步操作中用稀H2SO4浸洗的目的是 (填写字母编号)
a.除去未反应的NO3- b.除去未反应的I-
c.除去未反应的Fe d.除去碱性物质
(3)第⑦步操作可供提纯的两种方法是 和 (不要求写具体步骤)。
(4)实验室检验I2的方法是 。
(5)甲物质见光易变黑,其原因是(用化学方程式表示) 。
(6)(1)溶解银的硝酸应该用 硝酸(填浓或稀)。原因是
。
24.(8分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g) + B(g) 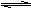 3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。
(4)若设容器体积为1L,温度不变,反应从逆反应开始 (反应物只有C和D ),按不同的配比作为起始物质,达到平衡时,C的浓度仍为1.2mol/L,则D的起始物质的量应满足的条件是___________。
23.(10分)在足量的稀氯化亚铁溶液中加入1-2滴液溴,振荡后溶液变为黄色。
(1) 甲同学认为是Br2溶于水变成黄色溶液 ; 乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)现提供试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断 (填“甲”或“乙”)的推断正确,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)①若选用淀粉碘化钾溶液判断哪位同学的推断正确,是否可行?(填“可行”或“不可行”):
________ ,理由: _____________________________ ;
②向稀溴化亚铁溶液中通入过量氯气的离子反应方程式: ______________ 。
22.(10分)为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔和溴发生了加成反应;乙同学发现甲同学的实验中,褪色的溶液里有少许淡黄色浑浊,推测甲在制得的气体中还含有少量的还原性杂质气体,由此乙同学提出必先将其除去,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要反应的化学方程式: 、 。
(2)甲同学设计的实验 (填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是 (多选扣分)
A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应就是加成反应
C.使溴水褪色的物质,未必是乙炔 D.使溴水褪色的物质,就是乙炔
(3)乙同学推测乙炔气体中必定含有一种杂质气体是(填化学式) ,它与溴反应的化学方程式是 。验证乙炔气体的过程中必须全部除去。
(4)如果选用下列编号为A、B、C、D的四种装置(有的可重复使用)来实现乙同学的实验方案。
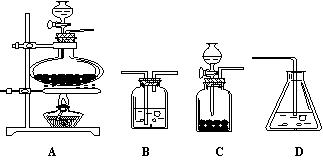
请你写出所选择装置编号(填在方框中)及装置中的化学药品名称(填在括号内)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com